CHAPITRE 11 : REACTIONS D`ESTERIFICATION ET D`HYDROLYSE

CHAPITRE 11 : REACTIONS D’ESTERIFICATION ET D’HYDROLYSE
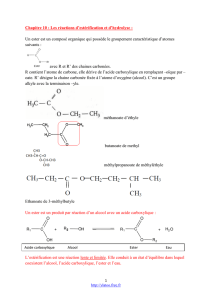
ESTERIFICATION ET HYDROLYSE
• Les esters sont une famille de composés organiques de formule générale:
Ils possèdent le groupe caractéristique ester : -COOR’
• Une réaction d'estérification modélise la transformation chimique
spontanée qui conduit à la formation d'un ester et d'eau à partir d'un acide carboxylique et d'un alcool.
• Le nom d’un ester dérive de ceux de l’acide et de l’alcool qui permettent de l’obtenir
ex : l’acide propanoïque C2H5COOH et le méthanol CH3OH conduisent au propanoate de méthyle C2H5COO-
CH3.
• La réaction d'hydrolyse d'un ester est la réaction inverse de l'estérification. Une transformation modélisée par
une réaction d'hydrolyse est également spontanée.
L'EQUILIBRE ESTERIFICATION-HYDROLYSE
• Les transformations modélisées par une réaction d'estérification ou d'hydrolyse sont limitées. Elles conduisent à
un état d'équilibre et sont formalisées par les équations:
R-COOH + R'OH = R-COOR' + H2O (estérification)
R-COOR' + H2O = R-COOH + R'OH (hydrolyse)
CONTROLE DE L'ETAT FINAL
• Le rendement d'une transformation est égal au taux d'avancement final en % de la réaction associée:
rendement = τ x 100
• Pour augmenter le rendement d'une réaction d'estérification, on a trois possibilités:
- utiliser l'un des réactifs en excès ;
- ajouter l'un des réactifs lorsque l'état d'équilibre est atteint;
- éliminer l'un des produits au fur et à mesure.
Dans les deux derniers cas, on dit que l'on déplace l'équilibre dans le sens direct.
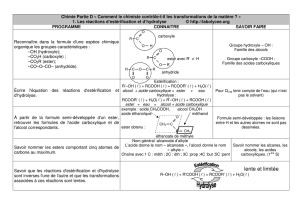
CONTROLE DE LA VITESSE DE REACTION
• Les transformations associées à des réactions
d'estérification ou d'hydrolyse sont lentes.
Pour augmenter la vitesse de ces
transformations, on peut augmenter la tem-
pérature ou utiliser un catalyseur.
• Un catalyseur est une espèce qui augmente
la vitesse d'une réaction chimique et de sa
réaction inverse mais ne figure pas dans l'équation de la réaction.
• Pour une estérification ou l'hydrolyse d'un ester, la température et la présence d'un catalyseur n'ont aucune
influence sur l'état d'équilibre du système.
Température T1
Température T2 > T1
Température T
1
et
catalyseur
Temps
COMPÉTENCES EXIGIBLES
Reconnaître dans la formule d’une espèce chimique organique les groupes caractéristiques : – OH, – CO2H, – CO2R, – CO – O – CO –.
- Écrire l’équation des réactions d’estérification et d’hydrolyse.
- À partir de la formule semi-développée d’un ester, retrouver les formules de l’acide carboxylique et de l’alcool correspondants.
- Savoir nommer les esters comportant cinq atomes de carbone au maximum.
- Savoir que les réactions d’estérification et d’hydrolyse sont inverses l’une de l’autre et que les transformations associées à ces réactions sont
lentes.
- Savoir qu’un catalyseur est une espèce qui augmente la vitesse d’une réaction chimique sans figurer dans l’équation de la réaction et sans
modifier l’état d’équilibre du système.
R C O R’ (R COOR’)
O
1
/
1
100%