Chimie II : 1S Cours

Chimie II : 1S Cours
Chapitre 9 : Les groupes caractéristiques
I. Groupes caractéristiques.
1. Définition :
Toute liaison autre qu’une liaison carbone-carbone simple ou une liaison carbone-hydrogène constitue un
groupe caractéristique ou fonction.
Les composés comportant le même groupe caractéristique appartiennent à une même famille car ils
possèdent des propriétés chimiques analogues.
2. Exemple :
3. Remarque :
Les molécules comportant une double liaison carbone-carbone appartiennent à la famille des alcènes.
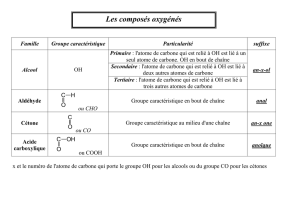
II. Les alcools.
1. Définition :
Un alcool possède le groupe caractéristique appelé groupe hydroxyle. La formule générale d’un alcool s’écrit
, R étant une chaîne carbonée.
Exemple :
R = C2H5
2. Nomenclature :
La nomenclature des alcools dérive de celle des alcanes comportant le même squelette carboné.
Le << e >> final de l’alcane est remplacé la terminaison << ol >> précédée de l’indice (le plus petit possible) du groupe
hydroxyle placé entre 2 tirets.
Exemples :
Nom : Propan-1-ol
3. Les trois classes d’alcools.
Les alcools primaires :
Le carbone portant le groupe hydroxyle appelé carbone fonctionnel (entouré en pointillé) est lié à
0 ou 1 atome de carbone.
Exemples :
Méthanol Ethanol
Formule générale :
Avec : R = H ou une chaîne carbonée.
Les alcools secondaires :
Le carbone portant le groupe (carbone fonctionnel) hydroxyle est lié à 2 atomes de carbone.
Formule générale : Avec R et R’ des chaînes carbonées.
Chimie II : 1S 1/5
C
C
H
H
H
H
H
O
H
Cette molécule comporte le groupe caractéristique :
c’est le groupe caractéristique des alcools. Elle fait partie de la famille des alcools.
O
H
R
O
H
Groupe hydroxyle
C
C
H
H
H
H
H
O
H
O
H
CH2
CH3
OH
CH2
C
C
H
H
H
H
H
O
H
C
H
H
H
O
H
CH2
R
OH
C
C
H
H
H
H
H
O
H
C
H
H
OH
CH
R
R’

Les alcools tertiaires :
Le carbone fonctionnel est lié à 3 atomes de carbone.
Formule générale :
Avec R, R’ et R’’ des chaînes carbonées.
4. Test d’identification : Voir TP.
Test à la solution acidifiée de permanganate de potassium (solution violette) :
Positif avec les alcools primaires et secondaires : on observe une décoloration de la solution.
Négatif avec les alcools tertiaires.
III. Les composés carbonylés :
Les composés carbonylés possèdent le groupe caractéristique carbonyle :
Parmi les composés carbonylés, on distingue deux familles :
Les aldéhydes.
Les cétones.
A. Les aldéhydes.
1. Formule :
Formule générale : Avec R = H ou une chaîne carbonée.
Exemple :
2. Nomenclature :
Pour nommer les aldéhydes, on remplace le << e >> final des alcanes possédant le même squelette carboné
par la terminaison << al >>. Le carbone du groupe fonctionnel possède toujours la position 1 dans la numérotation.
La molécule donnée dans l’exemple ci-dessus se nomme : propanal.
Remarque :
La fonction aldéhyde est toujours en bout ou en début de chaîne.
3. Test d’identification : Voir TP
Test à la liqueur de Fehling positif : formation d’un précipité rouge brique.
Test au réactif de Tollens positif : formation d’un miroir d’argent.
Test à la 2,4-DNPH (2,4-dinitrophénylhydrazine) positif : formation d’un précipité jaune-orange.
B. Les cétones :
1. Formule :
Formule générale : Avec R et R’ des chaînes carbonées
Exemple :
Chimie II : 1S 2/5
C
CH3
CH3
CH3
O
H
OH
C
R
R’
R’’
C
O
C
O
R
H
Groupe carbonyle
C
O
CH3
H
CH2
C
O
R
R’
CH3
CH3
CH2
C
O
Groupe carbonyle

2. Nomenclature :
Le nom d’une cétone dérive de celui de l’alcane ayant le même squelette carboné en remplaçant le <<e >> final
par la terminaison << one >> précédée d’un numéro (le plus petit possible), placé entre deux tirets, indiquant
la position du groupe carbonyle sur la chaîne principale.
La molécule donnée dans l’exemple précédent se nomme : butan-2-one
3. Test d’identification : Voir TP
Test à la 2,4-DNPH : positif
Test à la liqueur de Fehling : négatif
Test au réactif de Tollens : négatif
Remarques :
Le test à 2,4-DNPH est caractéristique du groupe carbonyle.
Pour différencier un aldéhyde d’une cétone, on effectue le test à la liqueur de Fehling ou le test au réactif
de Tollens.
IV. Les acides carboxyliques.
1. Définition et formule :
Un acide carboxylique possède le groupe caractéristique carboxyle :
Formule générale :
Avec R = H ou une chaîne carbonée
Exemple :
Remarque :
La fonction carboxyle est toujours en bout ou en début de chaîne.
2. Nomenclature :
Le nom d’un acide carboxylique dérive de celui de l’alcane ayant le même squelette carboné en remplaçant
le << e >> final par la terminaison << oïque >>, l’ensemble étant précédé du mot acide. Le carbone du groupe
carboxyle possède toujours la position 1 dans la numérotation.
La molécule donnée dans l’exemple précédent se nomme : acide-2-méthylbutanoïque.
3. Couple acide/base :
Les acides carboxyliques sont, comme leur nom l’indique, des acides, et sont donc capables de céder un proton
selon la demi-équation acido-basique suivante :
Ils font partie du couple acide/base suivant : RCO2H/RCO2-
4. Test d’identification : Voir TP
Test au papier pH : le papier pH prend une teinte acide.
Test au bleu de bromotyhmol (BBT) : le BBT prend une teinte jaune.
V. Les amines.
1. Définition et formule :
Une amine est un composé comportant un atome d’azote N lié à au moins un atome de carbone.
Formules générales :
Exemple :
Fonction amine
Chimie II : 1S 3/5
C
O
OH
OH
C
O
R
CH2
H
O
CH3
CH
C
CH3
Groupe carboxyle
O-
C
O
R
OH
C
O
R
+
H+
=
N
R
H
H
N
R
H
R’
N
R
R’’
R’
CH3
NH2
CH2

2. Couple acide/base :
Les amines sont en général des bases et sont donc capable de capter un proton selon la demi-équation
acido-basique suivante :
3. Test d’identification :
Test au papier pH : le papier pH prend une teinte basique
Test au bleu de bromothymol (BBT) : le BBT prend une teinte bleue.
4. Les acides aminés :
Ce sont des molécules organiques bifonctionnelles comportant les fonctions amine et acide carboxylique.
Exemple de l’alanine :
VI : Les halogénures d’alkyles ou composés halogénés.
1. Définition et formule :
On appelle halogénure d’alkyle tout composé organique possédant un atome d’halogène noté X (X = F, Cl, Br, I)
lié à une chaîne carbonée.
Formule générale : Avec : X = F, Cl, Br, I et R = chaîne carbonée
Exemple :
2. Nomenclature :
Le nom d’un halogénure d’alkyle s’obtient en plaçant, devant le nom de l’alcane ayant le même squelette carboné, l’un
des préfixes fluo-, chloro-, bromo-, ou iodo- précédé d’un numéro (le plus petit possible) indiquant la position du
ou des halogènes sur la chaîne carbonée.
Exemple :
La molécule donnée dans l’exemple précédent se nomme : 1-chloropropane.
3. Test d’identification :
Test à la solution alcoolique de nitrate d’argent : on observe la formation d’un précipité blanc noircissant
à la lumière.
Exercices d’application n° 1/2/3
VII. Réactivité des alcools.
1. Oxydation ménagée des alcools :
Une oxydation ménagée modifie uniquement le groupe caractéristique de la molécule, le squelette carboné
est inchangé.
L’oxydant utilisé est en général une solution aqueuse de permanganate de potassium acidifiée.
Réactivité des alcools en fonction des conditions expérimentales :
Réactif
Conditions expérimentales
Produit obtenu
Alcool primaire
Oxydant en défaut
Aldéhyde
Alcool primaire
Oxydant en excès
Acide carboxylique
Alcool secondaire
Oxydant
Cétone
Alcool tertiaire
Oxydant
Aucune réaction
Remarque : On utilise le cycle suivant pour symboliser une oxydation : [o].
Exercice d’application n°4/5
Chimie II : 1S 4/5
=
H+
N
R
H
H
+
N
R
H
H
H
+
R
X
Groupe halogéno
CH3
CH2
CH2
Cl
Groupe carboxyle
Groupe amine
H
O
C
CH
CH3
R
NH2

2. Déshydratation des alcools :
Une déshydratation est une réaction chimique au cours de laquelle une molécule d’eau est produite.
Les alcools peuvent donner lieu à une réaction de déshydratation quand ils sont chauffés en présence d’acide
sulfurique H2SO4(l) ou un catalyseur comme l’alumine Al2O3(s) :
Remarque :
Le groupe OH et l’hydrogène doivent être placés sur deux carbones adjacents.
3. Réaction de substitution :
Définition :
Au cours d’une réaction de substitution, un atome ou un groupe d’atome est remplacé par un autre atome
ou groupe d’atomes.
Par action d’un acide halogéné comme HCl, HBr, HF ou HI, les alcools subissent une substitution :
Avec X = F, Cl, Br, I
Le groupe hydroxyle est substitué par un halogène X. On obtient alors on halogénure d’alkyle.
Exercice d’application n°6
Chimie II : 1S 5/5
+
C
H
H
H
C
H
OH
H
H2SO4(l) ou Al2O3(s)
H
H
H
C
H
C
Alcène
H2O
X
R
OH
HX
R
+
+
H2O
 6
6
1
/
6
100%