Cours de chimie 1° S

Cours de chimie 1° S - Chapitre B3 :
REACTIVITE DES MOLECULES ORGANIQUES
1. Les alcanes
Les alcanes sont peu réactifs car leur chaîne carbonée est saturée et leur molécule ne
comporte aucun groupe caractéristique.
Ils ne peuvent réagir que si les conditions expérimentales sont favorables : température et
pression élevées, présence de catalyseurs*.
Un catalyseur est une espèce chimique qui accélère une réaction chimique mais qui
n'intervient pas dans son équation.
Ex : reformage catalytique de l'heptane
T = 500 °C
P = 15 à 30 bars
CH3 - (CH2)5 - CH3
CH3 - CH - CH2 - CH - CH3
Pt | |
CH3 CH3
2. Les alcènes
Les alcènes sont un peu plus réactifs, à cause de la présence dans leur chaîne carbonée d'une
double liaison qui constitue un point de fragilité.
L'ouverture de la double liaison permet à deux atomes ou groupes d'atomes de se fixer
(s'additionner) à la molécule. Il s'agit d'une réaction d'addition.
Exemple : addition d'eau sur l'éthylène
P = 70 bars
T = 300 °C
H2C = CH2 (g) + H – OH(g)
H3C - CH2 – OH(g)
H2SO4
Ethylène eau ethanol

3. Les alcools
3.1. Caractère réducteur des alcools
Les alcools sont beaucoup plus réactifs que les composés organiques précédents. Ce sont des
réducteurs dont la réactivité dépend beaucoup de la position du groupe caractéristique
hydroxyle (- OH) le long de la chaîne carbonée.
3.2. Les trois classes d'alcools
- alcool primaire : L'atome de carbone portant le groupe caractéristique est lié à 0 ou 1
atome de carbone.
Sa formule semi-développée générale est :
R - CH2 - OH
R = groupe alkyle R = CnH2n+1 ou R = H
Exemples :
H3C - OH CH3 - CH2 - OH
Méthanol Ethanol
- alcool secondaire : L'atome de carbone portant le groupe caractéristique est lié à
2 atomes de carbone.
Sa formule semi-développée générale est :
R - CH - OH
|
R'
R et R' = groupes alkyles : R - CnH2n+1 mais pas H
Exemple :
CH3 - CH - CH3
|
OH
Propan-2-ol

- alcool tertiaire : L'atome de carbone portant le groupe caractéristique est lié à 3 atomes
de carbone.
Sa formule semi-développée générale est :
R''
|
R - C - OH
|
R'
R, R' et R'' = groupes alkyles : R - CnH2n+1 mais pas H
Exemple :
CH3
|
CH3 - C - CH3
|
OH
méthylpropan-2-ol
3.3. Oxydation ménagée des alcools
L'oxydation ménagée des alcools ne modifie pas leur chaîne carbonée. Elle modifie
seulement le groupe caractéristique de la molécule.
Les produits formés sont différents selon la classe de l'alcool utilisé :
Alcools primaires
- Oxydant en défaut : l'alcool primaire est oxydé en aldéhyde.
Le couple redox mis en jeu est : R - CHO / R - CH2 - OH.
En solution aqueuse et en milieu acide, la demi-équation électronique est :
R - CHO(aq) + 2 H3O+(aq) + 2e- = R - CH2 - OH(aq) + 2 H2O(l)
- Oxydant en excès : l'alcool primaire est oxydé en acide carboxylique.
Le couple redox mis en jeu est : R - COOH / R - CH2 - OH.
En solution aqueuse et en milieu acide, la demi-équation électronique est :
R - COOH(aq) + 4 H3O+(aq) + 4 e- = R - CH2 - OH(aq) + 5 H2O(l)

Alcools secondaires
L'oxydation d'un alcool secondaire conduit à la formation d'une cétone. Le caractère
réducteur est moins important que pour les alcools primaires.
Le couple redox mis en jeu est : R - CO - R' / R - CHOH - R'.
En solution aqueuse et en milieu acide, la demi-équation électronique est :
R - CO - R'(aq) + 2 H3O+(aq) + 2e- = R - CHOH - R'(aq) + 2 H2O(l)
Alcools tertiaires
Les alcools tertiaires ne subissent pas l'oxydation ménagée.
3.4. Réactions de substitution
Au cours d'une réaction de substitution, un atome ou un groupe d'atomes de la chaîne
carbonée est remplacé par un autre.
Dans le cas des alcools, le groupe hydroxyle - OH peu être substitué par un atome d'halogène
X.
Exemple :
CH3- CH2- CH2-OH(aq) + H3O+(aq) + Cl-(aq)
CH3- CH2- CH2-Cl(aq) + 2 H2O(l)
propan1-ol chloropropane
3.5. Déshydratation
La déshydratation est une réaction d'élimination d'une molécule d'eau.
Ex : déshydratation de l'éthanol
T = 160 °C
H2C - CH2
H2C = CH2 + H-OH(l)
| | H2SO4
H OH
éthanol ethylene

4. Autres composés organiques
L'étude de ces composés n'est pas au programme de 1° S.
On retiendra simplement que :
les aldéhydes ont un caractère réducteur. Ils peuvent être oxydés en acide
carboxyliques R - COOH ou en ions carboxylates R - COO-, selon le pH.
les cétones sont très peu réactives
les acides carboxyliques R - COOH ont des propriétés acides. Leur base conjuguée est
l'ion carboxylate R – COO -.
les amines primaires R - NH2 ont des propriétés basiques. Leur acide conjugué est
l'ion R - NH3+.
les dérivés halogénés : peuvent participer à des réactions de substitution : l'atome
d'halogène X peut être substitué par un autre atome ou groupe d'atomes.
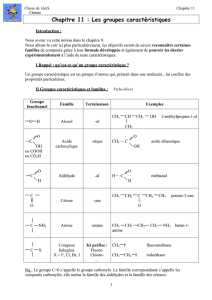
5. Tests de caractérisation
Famille
Réactif
Résultat
Commentaire
Alcools
R - OH
permanganate de potassium
décoloration de la
solution
oxydation de l'alcool
test négatif pour les alcools
tertiaires
aldéhydes
R - CH = O
liqueur de Fehling
précipité rouge-
brique, à chaud
oxydation de l'aldéhyde
tests spécifiques aux
aldéhydes
réactif de Tollens
précipité (miroir)
d'argent, à chaud
2,4-DNPH
précipité orangé
test commun aux aldéhydes
et aux cétones
Cétones
R1 - CO - R2
2,4-DNPH
précipité orangé
oxydation de la cétone
test commun aux aldéhydes
et aux cétones
Composés halogénés
R - X
nitrate d'argent
(solution alcoolique)
précipité blanc qui
noircit à la lumière
Acides
carboxyliques
R - COOH
Bleu de bromothymol
(B.B.T)
le B.B.T vire au jaune
mise en évidence
du caractère acide
Amines primaires
R - NH2
Bleu de bromothymol
(B.B.T)
le B.B.T vire au bleu
mise en évidence
du caractère basique
 6
6
 7
7
1
/
7
100%