Interleukine-6 et métastases osseuses du cancer du rein

LEPOINT SUR... Progrès en Urologie (2001), 11, 368-375
368
Interleukine-6 et métastases osseuses du cancer du rein :
bases moléculaires et implications thérapeutiques
Bernard PAULE
Service d’Urologie, Hôpital Henri Mondor, Créteil, France
L’interleukine-6 (IL-6) est une cytokine [28] qui agit
sur un grand nombre de cellules ; lymphocytes T et B,
hépatocytes, cellules cardiaques, progéniteurs hémato-
p o ï é t i q u e s … … L’IL-6 est un facteur de croissance
autocrine [25] et/ou paracrine [29] des cellules myélo-
mateuses. Dans le cancer du rein métastatique (CRm),
un certain nombre d’arguments cliniques et expérimen-
taux laissent penser que l’IL-6 est impliquée dans la
croissance tumorale, la progression des métastases
osseuses , l’hypercalcémie tumorale (45) et la résistan-
ce à l’immunothérapie [4, 46] Le CRm est résistant à la
chimiothérapie et l’efficacité de l’immunothérapie est
limitée en dépit de l’évaluation de nombreuses modali-
tés thérapeutiques [40, 41]. La connaissance des voies
de transduction de l’IL-6 autorise l’expérimentation de
nouvelles drogues ciblant ses différentes protéines
constitutives.
MECANISMES D’ACTION DE L’IL-6
Expression et production de l’IL-6
T
A K E N A
WA
[59] a montré que le gène de l’IL-6 était
détecté dans 22 des 43 cancers du rein primitifs et dans 7
lignées cellulaires de cancer du rein. L’ expression de
l’IL-6 a été mise en évidence par immunohistochimie
dans 70% des cancers du rein [47]. Elle n’est pas corré-
lée au stade tumoral (classification TNM), au type histo-
logique ou au grade de Furhman. Cependant l’expression
de l’IL-6 est plus souvent retrouvée dans les tumeurs
grade III de Furhman ou elle pourrait être impliquée dans
la progression tumorale ou être le témoin d’une dysrégu-
lation du contrôle du cycle cellulaire [47].
La production d’IL-6 mise en évidence dans certaines
lignées cellulaires de cancer du rein [62] est influencée
par d’autres cyrokines. Dans certaines lignées cellu-
laires du cancer du rein, le TNF- (Tumor Necrosis
Factor alpha) augmente la production d’IL-6 en syner-
gie avec l’Interferon gamma et stimule l’expression du
gène de l’IL-6 [30]. A l’inverse, TGF (Transforming
Growth Factor ) inhibe la production d’IL-6 [32] et
des cytokines comme l’IL-4 et L’IL-13 inhibent la
croissance des cellules rénales tumorales [42, 43].
Manuscrit reçu : mars 2000, accepté :décembre 2000.
Adresse pour correspondance : Dr. B. Paule, Service d’Urologie, Hôpital Henri
Mondor, 51, avenue du Maréchal de Lattre de Tassigny, 94010 Créteil.
e-mail : [email protected]
RESUME
L’interleukine 6 (IL-6) est une cytokine multifonctionnelle qui déclenche de multiples
signaux tissulaires et cellulaires. Elle est produite par plusieurs lignées cellulaires de
cancer du rein in vitro et est synthétisée par une majorité de cancers du rein. Un taux
sérique élevé d’IL-6 diminue la réponse à l’immunothérapie. L
’IL-6 apparaît comme
une cible thérapeutique pour le développement rationnel de nouveaux traitements .
Les effets de l’IL-6 sont médiés par les protéines Stat. Les voies de transduction des
Stat (Signal transducers and activators of transcription) représentent de nouvelles
cibles moléculaires pour traiter les cancers du rein métastatiques. Les inhibiteurs de
la voie des Stat ne bloqueraient pas seulement la croissance tumorale en induisant
l’apoptose mais augmenteraient aussi la sensibilité des tumeurs à un traitement
conventionnel (immunothérapie). Les processus impliqués dans l’ angiogénèse asso-
ciée aux tumeurs devraient aboutir à des composés capable d’interférer avec l’an-
giogénèse. L’IL-6 intervient dans la résorption osseuse ostéoclastique et l’hypercal-
cémie associées au cancer du rein métastatique. Différents agents ont montré leur
efficacité pour traiter la maladie osseuse lytique médiée par l’activation des ostéo-
clastes : bisphosphonates et osteoprotégérine.
Mots clés : Interleukin-6, cancer du rein métastatique, implications thérapeutiques.

369
Le récepteur de l’IL-6
Le site de liaison de l’IL-6 à la membrane cellulaire est
constitué par un récepteur spécifique IL-6R ou gp80 et de
l’élément de transduction correspondant gp 130. Il a été
mis en évidence dans 11 des 43 cancers du rein étudiés
par T
A K E N A
WA
[59]. Cependant l’ARN m de IL-6R était
présent dans toutes les tumeurs primitives et toutes les
lignées cellulaires tumorales. C
O S T E S
[13] a établi une
corrélation significative entre d’une part la présence de
IL-6R et d’autre part le stade tumoral selon Robson, le
grade de différenciation cellulaire, l’index de proliféra-
tion et la concentration sérique d’IL-6. Il n’y a pas de cor-
rélation entre IL-6R et la concentration sérique du récep-
teur soluble de l’IL-6 (sIL-6R). Par ailleurs, certaines
données expérimentales suggèrent que l’IL-6 pourrait
agir comme un facteur de croissance autocrine dans le
cancer du rein [35]. Ces résultats suggèrent que l’IL-6 et
son récepteur contribuent au développement ou à la pro-
gression de la croissance tumorale.
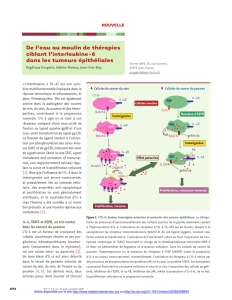
Mécanismes d’action de l’IL-6 (Figure 1)
L’IL-6 liée au récepteur IL-6R ou à sa forme soluble
(IL-6Rs) induit l’homodimérisation de gp 130 qui est
nécessaire à la transduction du signal à l’intérieur de la
cellule. Une première voie d’activation passe par diffé-
rentes tyrosines kinases de la famille des Janus kinases
et différents facteurs de transcription cytoplasmiques
appelés Stat (Signal transducers and activators of trans-
cription) [67]. Ces derniers après phosphorylation et
translocation au noyau se lient à l’ADN et régulent la
transcription de nouveaux gènes qui contrôlent les pro-
cessus de différenciation, de prolifération et d’apopto-
se cellulaire. Stat 3 et 5 sont activés dans un grand
nombre de tumeurs malignes (cancer du sein, céré-
braux, ORL, mélanome) et dans les proliférations
tumorales hématopoiétiques (myélome, leucémies
lymphoides et myéloides chroniques, leucémies aigues,
lymphomes malins non hodgkiniens) ou ils jouent un
rôle important dans la croissance tumorale.
L’activation des protéines Stat confère aux cellules
tumorales une résistance à l’apoptose et à la chimio-
thérapie durant la progression tumorale en induisant
l’expression de protéines antiapoptotiques. Ainsi Stat 3
active la transcription du gène Bcl-xL, protéine anti-
apoptotique de la famille bcl-2 [55]. Les protéines Bcl-
2 et Bcl-xL protègent les cellules tumorales de la des-
truction induites par la chimiothérapie. Dans le myélo-
me, l’activation de stat 3 par l’IL-6 confère aux cellules
myélomateuses une résistance à l’apoptose en indui-
sant l’expression de Bcl-xL qui joue un rôle dans la
résistance à la chimiothérapie [9].
Le profil d’activation par l’IL-6 des différentes pro-
téines stat n’a pas encore été défini dans le cancer du
rein. Sa connaissance ouvrira la voie à de nouvelles
recherches thérapeutiques (voir paragraphe 3).
Une deuxième voie aboutit, via Jak 2 à stimuler le
récepteur de l’EGF (EGF-R : Epidermal Growth Factor
Receptor) puis l’oncoprotéine Ras et la phosphoryla-
tion des protéines MAP (mitogen-activated protein)
kinase. A terme, le facteur de transcription NF-IL-6
(44) activé se lie à la sous unité p50 de NF-kB [10].
NF-IL-6 et NF-kB seuls ou associés activent en retour
la transcription du gène de l’IL-6 qui déclenche la
croissance cellulaire.
IL-6 ET METASTASES OSSEUSES
DU CANCER DU REIN
IL-6 et métastases osseuses
Il a été démontré par immunohistochimie que les méta-
stases osseuses expriment l’IL-6 notamment lors-
qu’elles sont peu différenciées [49]. L’IL-6 induit une
augmentation de la résorption osseuse ostéoclastique et
jouerait un rôle dans la croissance et l’extension des
métastases osseuses [45, 47]. Sécrétée par les méta-
stases osseuses, elle peut ou non s’accompagner d’une
élévation concomitante du taux d’IL-6 sérique. Un taux
sérique d’IL-6 élevé a été corrélé à une diminution de
Bernard Paule, Progrès en Urologie (2001), 11, 368-375
Figure 1. Voies de transduction de l’IL-6.
Abréviations :
EGFR : Epidermal Growth Factor Receptor.
Jak : Janus kinase.
Stat : Signal transducer and activator of transcriptor.
P : Phosphothyrosines.
MAP : Mitogen-Activated Protein.

la survie et à l’absence de réponse à l’immunothérapie
[3]. L’expression de l’IL-6 par le tissu osseux métasta-
tique et un taux sérique élevé d’IL-6 ont été associés à
la survenue d’une hypercalcémie tumorale [45].
IL-6, PTH-rP et hypercalcémie
L’IL-6 et sIL-6R augmentent la résorption osseuse
ostéoclastique et contribuent à la croissance des cel-
lules tumorales dans l’os en les protégeant de l’apopto-
se. La libération de calcium lors de la résorption osseu-
se module en retour la prolifération tumorale. Un taux
sérique élevé de Ca2+ augmente à la fois la synthèse et
la sécrétion d’IL-6 qui en retour lève l’inhibition de la
résorption osseuse induite par un taux élevé de Ca2+
[51]. Chez les patients avec un CRm et une hypercal-
cémie, l’expression d’IL-6 dans le tissu osseux méta-
statique a été associée à des concentrations sériques
élevées d’IL-6 libre et/ou liée à son récepteur soluble
[45]. Les patients avec une hypercalcémie et un taux
sérique élevé d’IL-6 peuvent avoir un taux sérique nor-
mal de PTH-rP. La PTH-rP est un important médiateur
local de la résorption osseuse [21] dont la production
est augmentée par l’IL-6 ou des facteurs dérivés de l’os
tels que TGF- . De LA MATA [14] a montré chez la sou-
ris que l’IL-6 augmente les effets de PTH-rP à la fois
sur la formation des ostéoclastes et sur la survenue de
l’hypercalcémie.
Dans le modèle de l’implantation des lignées cellu-
laires de cancer du rein utilisé par Weisglass et al [65,
66] chez la souris nude, les tumeurs indifférenciées
secrètent de grandes quantités d’IL-6 et de PTH-rP.
L’inhibition de la croissance tumorale et la diminution
du calcium sérique après traitement par des anticorps
anti IL-6 confirment que l’IL-6 est impliquée dans le
développement de l’hypercalcémie en stimulant la
croissance d’une sous population de cellules tumorales
secrétant PTH-rP et/ou celle de précurseurs ostéoclas-
tiques [66].
IL-6 et néoangiogénese
La néoangiogénèse tumorale contribue à la croissance
des métastases. Un certain nombre de facteurs de crois-
sance ou de cytokines angiogéniques ont été mis en évi-
dence dans le cancer du rein [7]. Des facteurs tels que
b-FGF (basic Fibroblast Growth Factor) sont produits
par les cellules tumorales rénales et la libération de
bFGF par la matrice extra cellulaire est corrélée à la
survie [56, 57]. Le VEGF (Vascular endothelial growth
factor), facteur de croissance des cellules endothéliales,
est synthétisé et secrété par les cancers du rein [6, 53,
54, 60, 64]. L’induction de l’angiogénèse est un méca-
nisme important et non spécifique par lequel VEGF
favorise la croissance tumorale. Ainsi, chez la souris
nude, un anticorps spécifique anti VEGF réduit la den-
sité des microvaisseaux et provoque l’inhibition rapide
de la croissance de 3 lignées tumorales humaines qui
produisent du VEGF comme seul médiateur de l’an-
giogénèse [27]. Un anticorps spécifique anti bFGF
inhibe la croissance de tumeurs murines VEGF dépen-
dantes [23]. L’injection intra péritonéale de bFGF aug-
mente la croissance de la tumeur primitive et de ses
métastases en stimulant la croissance des cellules endo-
théliales des capillaires de la tumeur [52]. VEGF est
stimulé par de nombreux facteurs de croissance ( TGF,
PDGF, HGF et bFGF ) et/ou des cytokines dont l’IL-6
[38, 63].
L’IL-6 produite par le cancer du rein et par les méta-
stases osseuses contribue à l’ angiogénèse tumorale par
l’intermédiaire du VEGF [12]. Le taux sérique de
VEGF a été corrélé avec le taux sérique d’IL-6, de C
Réactive Protéine (CRP), le taux de réponse, la pro-
gression tumorale précoce et la survie sans progression
des patients avec un CRm traités par Interféron alpha 2
(IFN- -2) et/ou Interleukine 2 (IL-2) [5].
Les protooncogènes ras (N-ras, K-ras et H-ras) codent
4 protéines appelées p21ras qui sont situées à la face
interne de la membrane cytoplasmique (Figure 1). Ces
protéines Ras stimulées par l’IL-6 augmentent l’ex-
pression de l’ARNm de VEGF et contrôlent les méca-
nismes de l’angiogénèse [20].
IL-6 et immunothérapie
Des taux sériques élevés d’IL-6, de CRP et de sIL-6R
sont des facteurs de mauvais pronostic chez les patients
métastatiques . Ils sont corrélés à l’absence de réponse
à l’IL- 2 et/ou à l’IFN -2a [3, 4]. L’IL-6 sécrétée par
les cellules tumorales induit la synthèse hépatique de
CRP [1, 2]. Chez 34 patients avec un CRm et un taux
sérique élevé de CRP avant chirurgie, FUJIKAWA [17]
suggère que la néphrectomie totale élargie est béné-
fique en réduisant la quantité d’IL-6 sécrétée par la
tumeur. L’immunothérapie est plus efficace et le pro-
nostic est meilleur chez les patients dont le taux de
CRP se normalise après chirurgie. La persistance d’un
taux élevé de CRP après néphrectomie est due à la pro-
duction d’IL-6 par les métastases. Chez 21 patients
avec un taux de CRP normal avant traitement aucune
différence en terme de survie n’est observé entre les
patients avec et sans néphrectomie. Dans ce groupe de
patients le taux sérique d’IL-6 est considéré comme
normal et la néphrectomie ne réduit pas la production
d’IL-6. Dans ce dernier groupe, 3 patients avec des
métastases osseuses ont été néphrectomisés sans voir
leur survie améliorée. L’expression de l’IL-6 par les
métastases osseuses peut être importante alors même
que le taux sérique d’IL-6 t de CRP sont normaux.
Dans ce cas la néphrectomie est inutile car l’IL-6 sécré-
tée localement stimule la résorption osseuse ostéoclas-
tique, la progression tumorale osseuse et la résistance à
l’immunothérapie [49].
370
Bernard Paule, Progrès en Urologie (2001), 11, 368-375

IMPLICATIONS THERAPEUTIQUES
Le taux de réponse objective (10-15%) obtenu par l’im-
munothérapie dans le CRm est insuffisant [39, 40]. La
résistance des métastases osseuses à l’immunothérapie
incite à rechercher de nouvelles cibles thérapeutiques.
Parmi celles ci, la dérégulation de la voie de signalisa-
tion de l’IL-6 constitue un modèle intéressant. Le
récepteur de l’IL-6 n’est exprimé que par 25% des
tumeurs mais il s’agit d’une population de tumeurs peu
sensibles à l’immunothérapie et à ce titre ne bénéficient
pas d’un traitement spécifique.
Blocage de la voie de l’IL-6
Au moins 3 nouvelles stratégies thérapeutiques pour-
raient être développée pour bloquer la voie de trans-
duction de l’IL-6 :
- les antagonistes de IL-6R
- les inhibiteurs de la voie d’activation des stat
- les antagonistes de Ras
Antagonistes des récepteurs de l’IL-6
Un antagoniste du récepteur de l’IL-6 se lie au récep-
teur de l’IL-6 et le bloque dans une configuration inac-
tive. Les superantagonistes des récepteurs de l’IL-6
(SANT 7) sont des facteurs proapoptotiques dans les
lignées de cellules myélomateuses XG-1 [15]. Ces
antagonistes pourraient bloquer la croissance des méta-
stases IL-6 dépendantes du CRm en interrompant la
voie de transduction de l’IL-6. Contrairement au myé-
lome, aucune étude n’ a été effectué dans le CRm. Le
développement actuel d’anticorps monoclonaux
comme C225 qui se lie spécifiquement à EGFR expri-
mé chez 80% des cancers du rein repose sur des
modèles précliniques. Dans plusieurs lignées cellu-
laires humaines de cancer du rein, l’anticorps C225
associé à un oligonucléotide antisense MBO RI a réduit
les lésions tumorales en augmentant l’apoptose [61].
Un essai phase II en cours (19) confirme l’intérêt de ce
type d’approche dans le CRm.
Inhibiteurs de la voie d’activation des Stats
Stat 3 est une cible moléculaire particulièrement inté-
ressante pour développer de nouveaux traitements. Des
inhibiteurs sélectifs des Jak 2 comme la Tyrphostin
AG 490 bloquent Stat 3 et induit l’apoptose dans un
modèle murin de cellules myélomateuses IL-6 dépen-
dantes [34]. Dans les lignées cellulaires de carcinome
épidermoide humain qui présentent une activation
intrinsèque de stat 3 résultant d’une stimulation auto-
crine de TGF a, des oligonucléotides antisense de stat
3 bloquent la croissance tumorale. L’interruption de la
voie de Stat 3 réduit l’expression de Bcl-xL et aug-
mente l’apoptose des cellules tumorales induites par
Fas (18). L’utilisation d’ inhibiteurs pharmacologiques
qui interrompent le mécanisme de phosphorylation des
Stat est aussi en cours d’étude. Dans le CRm, des inhi-
biteurs sélectifs de Jak 2 pourraient induire de la même
façon l’apoptose des métastases osseuses IL-6 dépen-
dantes.
Les antagonistes de Ras
Dans 10% des cancers du rein, les gènes ras mutés pro-
duisent des protéines Ras qui restent bloquées dans un
état activé. Par contre après stimulation par des fac-
teurs de croissance ou des cytokines telle l’IL-6, Ras
subit une farnésylation catalysée par une farnésyltrans-
férase (FTAase). Les inhibiteurs de FTAase entraînent
une régression tumorale. Couplés aux inhibiteurs de la
voie de transduction de l’IL-6, ils constituent une voie
d’approche complémentaire.
Les inhibiteurs de l’angiogénèse tumorale
Le traitement de souris porteuses d’un adénocarcino-
me rénal ou de tumeurs implantées à partir de lignées
cellulaires tumorales murines de cancer du rein avec
l’inhibiteur de l’angiogénèse tumorale TNP-470 dimi-
nue significativement la croissance tumorale et inhibe
la progression métastatique [11, 16, 37]. Chez 33
patients traités par TNP-470 à la dose de 60 mg/m
2
, 3
fois par semaine, S
TADLER
[58] a obtenu 1 réponse par-
tielle et 6 patients sont restés stables pendant plus de 6
mois.
L’utilisation d’anticorps dirigés contre le VEGF a pour
but d’ empêcher sa fixation sur son récepteur. Il est
aussi possible d’inhiber l’activité du récepteur en
modifiant son niveau d’expression dans la cellule
endothéliale. Des ribozymes spécifiques des récepteurs
du VEGF peuvent s’hybrider avec l’ARNm codant
pour le récepteur VEGF conduisant à sa dégradation et
à la perte d’expression du récepteur. L’activité du
récepteur peut être diminuée par compétition avec un
récepteur non fonctionnel comme le récepteur Flk1
muté à rôle de dominant négatif [26, 36]. Enfin des
inhibiteurs de l’activité thyrosine kinases [33] ou des
facteurs cytoplasmiques de la voie de transduction nor-
male induite par la liaison du VEGF à son récepteur
sont à envisager. Un anticorps anti VEGF (rhu Mab
VEGF ou bevacizumat) fait d’ores et déjà l’objet de
deux essais phase II randomisés dans le cancer bron-
chique et le cancer du colon et ouvre de nouvelles pers-
pectives thérapeutiques dans le CRm. Le thalidomide
qui inhibe l’angiogénèse, la production de bFGF, de
TNF- et d’IL-6 fait l’objet de Phase II.
Ras stimule l’expression de VEGF ; les inhibiteurs de
FTAase comme L-739,749 bloquent l’expression de
VEGF dans les cellules tumorales transformées par H-
ras [50] et inhibent l’angiogénèse tumorale induite par
l’IL-6.
371
Bernard Paule, Progrès en Urologie (2001), 11, 368-375

Les bisphosphonates (BP)
De nombreux essais cliniques ont montré que les BP
réduisent la douleur osseuse, l’incidence des frac-
tures pathologiques et des compressions médullaires
des patients atteints de myélome multiple avancé ou
de cancer du sein métastatique [46]. Par voie intra
veineuse, ils sont devenus le traitement de référence
de l’hypercalcémie tumorale car ils exercent une
activité anti ostéoclastique , induisent l’apoptose des
ostéoclastes (24) et inhibent la synthèse d’IL-6 par
les ostéoblastes; enfin ils entraînent une chute rapide
mais transitoire de la concentration sérique d’IL-6
[46]. Ils contribuent à limiter la libération à partir de
la matrice osseuse de facteurs stimulant le processus
ostéolytique et la progression des métastases
osseuses. Dans le CRm, les BP contrôlent l’hyper-
calcémie induite par l’IL-6 et inhibent la résorption
osseuse ostéoclastique.
Cependant, lorsque le taux de résorption osseuse
ostéoclastique est élevé, l’inhibition de l’activité ostéo-
clastique par le pamidronate est moins efficace même
s’il est administré à des doses importantes (120 mg).
Dans le CRm, une étude préliminaire [49] portant sur
9 patients avec des métastases osseuses IL-6 dépen-
dantes et des taux sériques élevés d’IL-6 montre que
contrairement au modèle murin établi dans le cancer
du sein [52], les BP ne préviennent pas l’extension et
l’apparition de nouvelles métastases [47]. La réduction
de la masse cellulaire tumorale serait un préalable à
l’efficacité des BP.
Dans les métastases osseuses du cancer du rein, des
essais thérapeutiques sont nécessaires pour apprécier
l’efficacité antalgique, la diminution de la morbidité
osseuse et l’activité antitumorale potentielle des BP
utilisés seuls ou en association avec des molécules blo-
quant l’action de l’IL-6.
L’ostéoprotégérine (OPG)
Des études récentes [31] ont identifié le ligand de l’os-
teoprotegerine (OPG-L) comme un facteur essentiel
nécessaire à l’ostéoclastogénèse dont les effets sont
prévenus par son récepteur soluble l’ostéoprotégérine
(OPG). Celle ci est un membre de la famille TNF
(Tumor Necrosis Factor) qui agit en inhibant le déve-
loppement des ostéoclastes. L’OPG bloque la différen-
ciation proostéoclastique des précurseurs hématopoïé-
tiques [54] et est aussi un traitement efficace de l’hy-
percalcémie et de sa prévention dans un modèle murin
d’hypercalcémie maligne [8]. Associée aux BP, elle
réaliserait un blocage complet de la résorption osseuse
ostéoclastique car la stimulation de l’ostéoclastogénè-
se par l’IL-6 est indépendante de l’expression de
l’OPG-L [22].
CONCLUSION
Dans le CRm, l’IL-6 est impliquée dans la progres-
sion des métastases et la résistance à l’immunothéra-
pie. Les voies de transduction induites par l’IL-6 et
son récepteur ouvrent la voie à de nouvelles perspec-
tives thérapeutiques différentes de l’immunothérapie.
Les inhibiteurs de la voie des Stat ne bloqueraient pas
seulement la croissance tumorale en induisant
l’apoptose mais augmenteraient aussi la sensibilité
des tumeurs à un traitement conventionnel. Les pro-
cessus impliqués dans l’angiogénèse associée à la
croissance des métastases osseuses devraient aboutir
à l’utilisation d’agents pharmacologiques capables
d’interférer avec elle. Différents agents ont montré
leur efficacité pour traiter la maladie osseuse lytique
médiée par l’activation des ostéoclastes. Ainsi les BP
et l’OPG pourraient jouer un rôle complémentaire
pour diminuer la morbidité liée au métastases
osseuses et limiter leur progression. Les BP sont
d’ores et déjà le traitement de référence de l’hyper-
calcémie due aux métastases ostéolytiques.
L’ensemble de ces molécules font ou devraient faire
l’objet d’essais thérapeutiques dans le futur.
REFERENCES
1. AMIRA S., KISHIMOTO T. IL-6 and aNF-IL-6 in acute phase res-
ponse and viral infection. Immunol Rev., 1992, 127, 25-28.
2. BAUMANN H., PROWSE K.R., MARINKOVIC S., WON K.A., JAH-
REIS G.P. Stimulation of hepatic acute phase response by cytokines and
glucocorticoides. Ann. N.Y. Acad. Sci., 1989, 557, 280-285.
3. BLAY J.Y., NEGRIER S., COMBARET V., ATTALI S., GUILLOT
E., MERROUCHEY, MERCATELLO A., RAVAULT H., TOURA-
NI J.M., MOSKOOTCKENKO J.F., PHILIP T., FAVROT M. Serum
level of interleukin 6 as a prognosis factor in metastatic renal cell
carcinoma. Cancer Res., 1992, 52, 3317-22.
4. BLAY J.Y., PALLARDY A., RAVAUD S., NEGRIER S.,
DOUILLARD J.Y., CHEVREAU C., FLEURY J., RAY I., ESCU-
DIER B., LASSET C.for the French immunotherapy group-
FNCLCC. Serum IL-6 , soluble gp80 IL-6 receptor and CRP in
metastatic renal cell carcinoma (MRCC) treated with immunothera-
py in the Crecy trial. Correlation to response. Ann Oncol., 1996, 7
(Suppl. 5), Abstr. 2540.
5. BLAY J.Y., PALLARDY M., RAVAUD A., CAUX C., NEGRIER S.,
DOUILLARD J.Y., CHEVREAU C., FLEURY J., RAY I., ESCU-
DIER B., LASSET C. for the French immunotherapy group-
FNCLCC. Serum VEGF is an independent prognostic factor in
patients with metastatic renal carcinoma treated with IL-2 and /or
IFN ; analysis of the CRECY trial. Proc. Am. Soc. Clin. Oncol.,
1999, 18, 1669.
6. BROWN L.F., BERSE B., JACKMAN R.W., TOGNAZZI K., MAN-
SEAU E.J., DVORAK H.F., SENGER D.R. Increased expression of
the vascular permeability factor (vascular endothelial growth factor)
and its receptor in kidney and bladder carcinoma. Am. J. Pathol.,
1993, 143, 1255-1262.
7. CAMPBELL S.C. Advances in angiogenese research : relevance to
urological oncology. J. Urol., 1997, 158, 1663-1674.
372
Bernard Paule, Progrès en Urologie (2001), 11, 368-375
 6
6
 7
7
 8
8
1
/
8
100%