Corrigé - Université du Maine

Université du Maine - Faculté des Sciences ⌫ Retour LCU4 – Chimie Organique : Corrigé Sept.2002
Chimie Organique – Corrigé
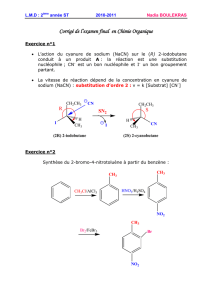
I – Exercice 1
Cl
HCH3
C2H5
H
CH3CH3
C2H5
CH3
H
OH2
HCH
3
C2H5
H
CH3CH3
C2H5
HH3C
(1R,2R) A1 B
tBuO
CH3
C2H5
CH2
H
+
E2
C2H5
H
CH3
CH3
H
C2H5
H
CH3
CH3
H
=
CH3
C2H5
CH3
H
E1
(1R,2R) A1 A2
L'élimination sur le chlorure est une réaction de type E2 qui conduit majoritairement à l'alcène de Saytzeff A1 qui est E
(attention les deux groupes méthyle n'ont pas la même priorité sur les deux carbones). Comme la base est très encombrée, il y a
aussi attaque sur le CH3 qui est plus "dégagé", conduisant à l'alcène d'Hofmann.
Après protonation, l'alcool lui subit une élimination de type E1 : il y a passage par un carbocation et formation des deux alcènes
de Saytzeff Z et E. Il n'y a aucune raison dans ce cas pour former l'alcène d'Hofmann.
Si la réaction a lieu dans le t-butanol, ce solvant protique, solvate l'anion t-butylate qui est dans ce cas moins réactif = moins
nucléophile : la réaction est ralentie.
Si on utilise le méthylate comme nucléophile, celui ci est une
base moins encombrante et a moins de raison d'attaquer
l'hydrogène du groupe méthyle : la proportion d'alcène
d'Hofmann diminue. De plus le méthylate moins encombrant est
plus nucléophile. Il donne donc une SN2 avec inversion de la
configuration.
Cl
HCH
3
C2H5
H
CH3
CH3O
H
CH3
C2H5
OCH3
CH3
H
(1R,2R) C (1S,2R)
Cette dernière observation illustre la différence entre la basicité et la nucléophilie.
II- Exercice 2
Dans la DMF, le dioxane, et le THF solvants non protiques, l'ion phénate est très réactif (nucléophile) et une réaction SN2
(flèche bleue) conduit à l'éther. Dans l'eau, solvant protique, l'ion phénate est solvaté par liaisons hydrogène et moins réactif ;
dans ce cas c'est le noyau aromatique qui est le nucléophile et il se produit une SE (flèche verte-probablement après formation
du carbocation benzylique lui-même stabilisé dans l'eau solvant polaire)
OO
O
H2C
+ ClCH2
+ para
III – Exercice 3
Expliquer les résultats suivants . Ecrire les mécanismes des réactions qui conduisent à ces résultats.

Université du Maine - Faculté des Sciences ⌫ Retour LCU4 – Chimie Organique : Corrigé Sept.2002
OOH
O
O
OOH
(R )
NaOH/5N
NaOH/ dilué
(R)
(R) (R)
(R + S)
NaOH/5N
NaOH/ dilué
OH
(R + S)
BAc2
BAl1 = SN1
OH
BAc2
plus de conjuguaison
plus stable
plus de conjuguaison
plus stable
IV – Exercice 4 : Synthèses
1. Le propène est halogéné en position allylique (SRad). La présence de traces de HBr est nécessaire pour obtenir du brome qui
donnera les radicaux correspondants mais HBr doit rester en faible concentration pour éviter l'AdE sur la double liaison. Le
diphénylméthane donne un carbanion stabilisé par mésomérie sur les cycles aromatiques; c'est un réactif nucléophile qui
déplace le brome dans une SN. La double liaison est oxydée en époxyde (c'est aussi une AdE). L'ouverture de l'époxyde (SN2)
sur le carbone primaire par l'amine conduit au produit final (E).
CH2Br CH - Na+CH CH
O
CH
HO
HN
A
B C D E
2.Il y a d'abord deux substitutions électrophiles sur le cycle aromatique, puis formation d'un dérivé magnésien avec le brome.
La réaction sur le CO2conduit à l'acide qui subit une double nitration en ortho du chlore. La réaction suivante est une
substitution nucléophile aromatique dont le mécanisme sera envisagé au prochain semestre. Il faut deux équivalents d'amine
car cette amine donne probablement un sel avec l'acide. L'acide est ensuite transformé en chlorure d'acide qui est lui-même
réduit en aldéhyde et une autre réduction conduit à la propaline.
Cl Cl
Br
Cl
COOH
Cl
COOH
O2NNO2
N(Et)2
O2NNO2
N(E
t
)2
CH3
O2NNO2
A B C D E F
COOH
On peut se demander pourquoi on utilise pas directemment le para chlorotoluène au lieu de l'acide para chlorobenzoïque,
mais dans la substitution nucléophile aromatique un groupe donneur est défavorable.
1
/
2
100%