La péricardite chronique constrictive

Keywords : Constrictive pericarditis, Doppler echocardiography, cardiac catheterisation, pericardiectomy
Moroccan Journal of Cardiology© 2012. Mor J Cardiol 2012; 7: 16-20
Mots clés : Péricardite chronique constrictive, écho-Doppler cardiaque, cathétérisme cardiaque, péricardectomie
La péricardite chronique constrictive (PCC) est une maladie
inammatoire chronique du péricarde. Elle est caractérisée
par la transformation du péricarde en une coque breuse
plus ou moins épaisse, parfois calciée responsable d’une
gêne au remplissage ventriculaire. Le diagnostic repose
essentiellement sur la clinique, la radiographie thoracique,
l’écho-Doppler cardiaque et le cathétérisme droit. Il peut
être difcile dans certains cas justiant le recours à d’autres
techniques d’imagerie (TDM et IRM). Le diagnostic
différentiel principal est la cardiomyopathie restrictive.
La péricardite chronique constrictive intéresse
habituellement les deux ventricules, et prédomine
souvent au niveau du ventricule droit.
La constriction péricardique gêne l’élongation
diastolique des bres myocardiques, et donc le
remplissage diastolique des cavités cardiaques. Cette
gêne de remplissage ventriculaire dénit l’adiastolie1,2.
Pendant la proto-diastole, la paroi ventriculaire se
distend rapidement mais le mouvement est brusquement
limité et suivi d’une immobilité complète en méso et en
télé-systole, à l’origine de l’aspect en « dip-plateau »
Les étiologies sont dominées par la tuberculose dans
les pays en voie développement. Néanmoins, elle est
en nette régression dans les pays occidentaux grâce aux
progrès réalisés dans la prophylaxie et les traitements
anti-infectieux. La radiothérapie et la chirurgie cardiaque
à cœur ouvert sont les deux étiologies principales dans
ces pays.
Constrictive pericarditis
Mise au Point Thématique
La péricardite chronique constrictive
Résumé : La péricardite chronique constrictive est une affection inflammatoire du péricarde, caractérisée par un
épaississement péricardique fibro-calcaire. Cet épaississement est responsable d’une gêne au remplissage ventriculaire
définissant ainsi l’adiastolie. Les étiologies sont dominées par la tuberculose dans les pays en voie de développement. Le
tableau clinique est souvent non spécifique. Le diagnostic peut être difficile dans certains cas. Il est posé essentiellement par
la radiographie thoracique, l’écho-Doppler cardiaque et le cathétérisme cardiaque. La péricardectomie subtotale est nécessaire
dans les formes sévères de la maladie.
Physiopathologie
Etiologies
Summary : Constrictive pericarditis is caused by fibrosis and calcification of the pericardium that inhibit diastolic
filling of the heart. It’s usually secondary to tuberculous pericarditis in developing countries. Clinical picture is not
specific. Chest radiography, two dimensional and Doppler echocardiography, cardiac catheterisation and imaging
methods are very useful for diagnosis which may be challenging in some cases. Subtotal pericardiectomy is necessary
in severe cases.
mis en évidence par le cathétérisme cardiaque.
Cette atteinte péricardique rend le cœur relativement
indépendant du reste du thorax, en particulier lors des
mouvements respiratoires. En outre, elle fait travailler
le cœur à volume constant. Ainsi, à l’inspiration, la
pression ventriculaire gauche reste constante mais celle-
ci chute dans les veines pulmonaires ce qui diminue le
remplissage ventriculaire gauche. Cependant, la pression
ventriculaire droite augmente, ce qui est responsable
d’une augmentation des pressions en amont avec
apparition des manifestations d’insufsance ventriculaire
droite (puisque le volume cardiaque total est constant).
A l’extrême, on assiste à une interdépendance
ventriculaire secondaire à une déviation du septum
interventriculaire vers le ventricule gauche (septum
paradoxal) qui aggrave d’avantage la chute du débit
cardiaque (gure 1).
N. El Khorb, L. El Ouali, I. Lahlou, L. Ouaha, H. Akoudad
Service de Cardiologie, CHU Hassan II, Fès, Maroc.
Auteur correspondant: Dr. Nada El Khorb
Service de Cardiologie, CHU Hassan II, Fès, Maroc.
16

La constriction se développe très lentement et elle reste
méconnue pendant longtemps. Le traitement par une
corticothérapie permet de diminuer la mortalité (4% contre
11% dans le groupe placebo) et de limiter le recours à la
chirurgie3.
Le syndrome de PICK qui associe des signes d’hypertension
portale et d’hypertension veineuse périphérique est rarement
complet. L’examen clinique est normal dans 20% des cas. La
pression artérielle est souvent abaissée, avec parfois un pincement
de la différentielle. Lors de l’inspiration, les chiffres de tension
artérielle peuvent diminuer (pouls paradoxal de Kusmaull). Une
déviation du choc de pointe peut être présente. L’auscultation
peut révéler une tachycardie régulière, isolée dans 1/3 des cas.
Un troisième bruit diastolique est présent dans plus de la moitié
des cas9. Il est pathognomonique de la présence de calcications
péricardiques. Ce bruit est protodiastolique, maximum à l’apex,
parfois vibrant (bruit myocardique dû à l’impact de la colonne
sanguine sur une paroi ventriculaire inextensible).
C’est la cause la plus fréquente des constrictions
péricardiques, dans les pays occidentaux. Elle complique
la chirurgie cardiaque notamment les pontages
aorto-coronaires et les remplacements valvulaires4,5.
Plusieurs hypothèses ont été proposées pour expliquer cette
constriction. Les deux principales sont l’hémorragie post
opératoire et l’utilisation d’un matériel étranger au moment
de l’intervention responsables d’une réaction inammatoire
chronique avec apparition d’une brose6.
La radiothérapie médiastinale dans le cadre d’une maladie
de Hodgkin est la cause la plus fréquente7. La constriction
péricardique peut survenir 5 ou 10 ans après la radiothérapie.
Elle est généralement associée à une pancardite.
Les modications électriques sont fréquentes mais non
spéciques (onde P bide, microvoltage, alternance
électrique et anomalies de la repolarisation diffuses)
(gure 2). La brillation auriculaire est fréquente
dans les formes évoluées (20% des cas)9. Un bloc
auriculo-ventriculaire de premier degré est noté dans 8 à 10%
des cas.
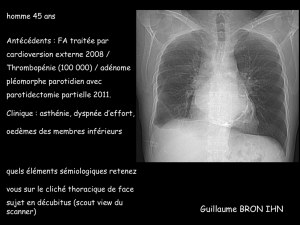
Classiquement, l’index cardiothoracique est normal dans une
péricardite constrictive. Une cardiomégalie peut être observée
en cas d’épaississement péricardique important et surtout en
cas d’épanchement associé. Il est nécessaire de rechercher
des calcications, mieux visibles sur le cliché de prol. Il est
parfois nécessaire d’évaluer la cinétique du cœur en scopie,
ce qui permet de mieux voir les calcications péricardiques
(gure 3).
C’est le cas de l’insufsance rénale chronique, de certaines
maladies de système (polyarthrite rhumatoïde, lupus),
des infections bactériennes ou virales et les traumatismes
thoraciques.
Dans la plupart des séries, la constriction péricardique reste
idiopathique8. Elle correspond très probablement à des
cas de péricardites virales anciennes mais dont la preuve
infectieuse n’a pas pu être faite.
La dyspnée d’effort est le symptôme le plus fréquemment
rencontré (85% des cas). La dyspnée de décubitus est retrouvée
dans 20 à 30% des cas. Une asthénie généralisée est présente dans
30 à 50% des cas et une hépatalgie d’effort dans 10 à 30% des cas8.
La tuberculose
Signes physiques
La constriction post-chirurgicale
La constriction post-radique
Electrocardiogramme
La radiographie thoracique
Les autres causes sont plus rares
La constriction idiopathique
Circonstances de découverte
Signes fonctionnels
Tableau clinique
Examens paracliniques
Figure 2. Aspects électriques d’une péricardite chronique constrictive:
Microvoltage, alternance électrique et troubles de la repolarisation diffus
Figure 1. Physiopathologie de la péricardite chronique constrictive. PVG.
Pression dans le ventricule gauche. PVP. Pression veineuse pulmonaire.
VP. Veines pulmonaires. OG. Oreillette gauche. VG. Ventricule gauche.
Constriction péricardique
Gêne au remplissage
ventriculaire
Adiastolie
Dissociation des
pressions
(cœur et thorax)
Durant l’inspiration
Retour veineux PVG constante
PVP
Gradient
VP/OG/VG
Remplissage
VG
Remplissage
droit
Interdépendance
Ventriculaire
(septum paradoxal)
La découverte d’une constriction péricardique peut être
dans les suites immédiates d’une péricardite idiopathique,
en post radiothérapie, après une chirurgie cardiaque ou
également après plusieurs années d’une guérison apparente
d’une atteinte péricardique.
N. El Khorb et al Mor J Cardiol 2012; 7:16-20
17

Le diagnostic positif de la péricardite chronique constrictive
à l’écho-Doppler cardiaque est de difculté variable en
fonction du stade évolutif de la constriction. L’analyse doit
être minutieuse à la recherche de signes de constriction et
d’adiastolie.
Les signes échographiques en mode TM et en mode
bidimensionnel (2D) d’une péricardite chronique constrictive
ne sont ni sensibles ni spéciques.
En mode 2D, Le diagnostic est évoqué devant la présence d’un
épaississement péricardique en association avec une dilatation
modérée des deux oreillettes et de la veine cave inférieure
contrastant avec des ventricules de taille normale. Une rupture
de l’alignement entre la paroi postérieure du ventricule gauche
et de la paroi postérieure de l’oreillette gauche est parfois
observée en incidence parasternale grand axe (gure 4).
En mode TM, trois signes sont évocateurs d’une constriction
péricardique :
- Un aspect de dip plateau au niveau du septum : mouvement
antérieur paradoxal du septum avec un brusque recul proto-
diastolique.
- Une rectitude de la paroi postérieure avec une disparition du
recul télédiastolique.
- Une ouverture prématurée des sigmoïdes pulmonaires (signe
plus rare), liée à l’égalisation des pressions dans les cavités
cardiaques10.
L’analyse Doppler est un temps essentiel dans le diagnostic d’une
constriction péricardique11. Elle consiste en une analyse des ux
mitral et tricuspide et des ux dans les veines pulmonaires et
dans les veines sus hépatiques. Cette étude permet de rechercher
les signes d’adiastolie et surtout les variations respiratoires des
ux. Ces variations permettent de différencier une PCC d’une
cardiomyopathie restrictive (CMR). Elles sont expliquées par le
phénomène d’interdépendance ventriculaire et par la dissociation
entre la pression intra-thoracique et intra-cardiaque responsables
d’une déviation septale vers la gauche en inspiration.
L’étude du ux mitral met en évidence une grande onde E, un
TDE court < 150 ms et une petite onde A. Cet aspect est retrouvé
également dans les cardiomyopathies restrictives. Cependant, la
baisse de l’onde E de plus de 25% en inspiration et le retour à la
valeur de base en expiration est un signe très sensible en faveur
de la constriction péricardique (gure 5). Au Doppler tissulaire,
la vitesse de l’onde E à l’anneau est normale (> 8 cm/s) alors
qu’elle est diminuée dans la CMR12.
L’étude du ux veineux pulmonaire objective une diminution de
l’onde S et une augmentation de la vitesse et de la durée de l’onde
A. Par ailleurs, l’onde D augmente au cours de l’expiration et
diminue au cours de l’inspiration. Une baisse de la vitesse de
l’onde D en inspiration supérieure à 40% est en faveur d’une
constriction péricardique13.
L’analyse du ux tricuspide objective une grande onde E avec
un TDE court. Inversement, on note une augmentation de plus
de 25% de l’onde E en inspiration (gure 5). L’analyse du ux
veineux sus hépatique révèle une diminution de l’onde S et une
augmentation de l’onde A12.
Enn, l’échocardiographie transoesophagiene peut être utile
dans le diagnostic d’une PCC car elle permet une meilleure
visualisation du péricarde et une meilleure analyse du ux
veineux pulmonaire.
Echocardiographie Doppler
Figure 4. Incidence échographique parasternale grand axe montrant
une rupture de l’alignement entre la paroi postérieure du ventricule
gauche et de la paroi postérieure de l’oreillette gauche.
Figure 5. Variations des ux mitral et tricuspide à l’inspiration. Noter
l’aspect restrictif du ux mitral avec un TDE court.
Analyse morphologique
Analyse Doppler
Figure 3. Visualisation des calcications péricardiques sur une
radiographie thoracique
N. El Khorb et al Mor J Cardiol 2012; 7:16-20
18

La conrmation hémodynamique de la constriction
péricardique associe14:
- Un changement de la morphologie des courbes de pression.
- Une augmentation et une égalisation de pressions diastoliques
dans les quatre cavités.
- Une diminution du débit cardiaque avec un index cardiaque
subnormal ou diminué.
Le cathétérisme cardiaque droit permettra d’objectiver une
tendance à l’égalisation des pressions diastoliques depuis les
veines périphériques jusqu’au capillaire pulmonaire et à la
pression télédiastolique du ventricule gauche. Il n’y a pas de
gradient entre le ventricule droit et l’oreillette droite. La pression
moyenne de l’oreillette droite est élevée jusqu’à 20-30 mmHg.
La pression télédiastolique du ventricule droit est très élevée,
elle atteint ou dépasse le tiers de la pression systolique. Enn,
La pression diastolique de l’artère pulmonaire est également
élevée, équivalente à la pression diastolique ventriculaire
droite et à la pression moyenne de l’oreillette droite.
Au niveau du ventricule droit, on note l’aspect typique de
dip-plateau (gure 6), ou aspect en racine carrée avec en
proto-diastole une pression normale mais dès le début
de la diastole, il existe une remontée abrupte suivie
d’un plateau méso et télé-diastolique.
Ces examens permettent une meilleure visualisation du
péricarde. Au scanner, un épaississement du péricarde
supérieur ou égal à 4 mm, localisé ou diffus, associé ou non à
des calcications est en faveur d’une constriction péricardique
(gure 7). Cependant, ces données morphologiques doivent être
confrontées aux anomalies hémodynamiques au Doppler et au
cathétérisme pour conrmer le diagnostic15.
Cathétérisme cardiaque droit Scanner et résonnance magnétique nucléaire
Figure 7. Coupe scannographique montrant la présence de
calcications péricardiques
Figure 6. Aspect de dip-plateau au cathétérisme cardiaque droit
La cardiomyopathie restrictive est le principal diagnostic
différentiel avec une constriction péricardique (tableau 1).
En faveur d’une CMR, la présence de signes d’insufsance
cardiaque gauche, d’un bruit de galop, d’un soufe de
fuite mitrale ou tricuspide. A l’ECG, une hypertrophie
ventriculaire gauche est fréquente. L’écho-Doppler
cardiaque a une place importante dans le diagnostic
différentiel. Il montre un épaississement des parois
ventriculaires avec des oreillettes plus dilatées que dans
une PCC. Le ux mitral est restrictif mais les variations
respiratoires sont faibles. Par ailleurs, le Doppler tissulaire
met en évidence une vitesse de l’onde E à l’anneau
diminuée (< 8 cm/s). Enn, l’IRM apporte des arguments
supplémentaires en faveur de la CMR16.
Diagnostic différentiel
PCC CMR
Tableau 1. Diagnostic différentiel entre cardiomyopathie restrictive et péricardite chronique.
Signe de Kusmaull fréquent
Choc de pointe non palpable
Vibrance péricardique
Microvoltage, troubles de la repolarisation diffus, FA
Epaisseur normale des parois
Dilatation biauriculaire modérée
Péricarde épaissi > 3 mm (ETO)
Déplacement antérieur brutal du SIV en phase
précoce de remplissage
Variation respiratoire importante de E (>25 %)
Ea > 8 cm/s
PTDVD et PTDVG souvent équivalents
Pression systolique VD < 50 mm Hg
PTDVD > 1/3 pression systolique VD
Normale
Péricarde habituellement épaissi
Examen clinique
ECG
Echographie cardiaque
Doppler
Doppler tissulaire
Hémodynamique
Biopsie endomyocardique
TDM/IRM
FA. Fibrillation auriculaire, HVG. Hypertrophie ventriculaire gauche, ETO. Echocardiographie transoesophagienne, PTDVD. Pression télédiastolique du VD.
Signe de Kusmaull possible
Choc de pointe augmenté
Bruit de galop
Soufe de régurgitation
Microvoltage (amylose), onde Q, HVG
Epaississement des parois
Dilatation biauriculaire importante
Variation respiratoire faible de E (˂15 %)
Ea ˂ 8 cm/s
PTDVG souvent > PTDVD (5 mmHg)
Cause spécique (amylose…)
Péricarde habituellement normal
N. El Khorb et al Mor J Cardiol 2012; 7:16-20
19

Traitement médical
Traitement chirurgical
Le traitement médical dans la péricardite chronique
constrictive est symptomatique en attendant la chirurgie. Il
comprend essentiellement les diurétiques (en plus d’un régime
désodé) pour lutter contre les signes de congestion systémique.
L’évacuation d’un épanchement pleural ou du liquide d’ascite
peut s’imposer dans certains cas avancés. Par ailleurs, l’anti-
coagulation est indiquée à visée prophylactique au cours
des décompensations aigues et à visée curative en cas de
brillation auriculaire associée.
Dans certains cas, le traitement peut être étiologique: traitement
anti-bacillaire en cas de tuberculose conrmée ou fortement
suspectée, corticothérapie en cas de maladie de système….
Le diagnostic d’une PCC peut être difcile nécessitant
la réalisation de plusieurs examens en particulier
l’échocardiographie et le cathétérisme cardiaque. La
visualisation du péricarde au scanner ou à l’IRM s’impose
dans certains cas douteux. Cependant, l’outil diagnostique
C’est le seul traitement efcace de la constriction péricardique.
Il consiste en une décortication des deux feuillets du péricarde
par sternotomie médiane avec ou sans circulation extra-
corporelle.
La décortication doit être d’abord réalisée au niveau du
ventricule gauche pour éviter le risque de survenue d’un
œdème pulmonaire après libération du ventricule droit (par
surcharge pulmonaire). La pericardectomie doit être subtotale
au niveau des ventricules. Dans les formes calciées, cette
intervention peut être difcile du fait de l’absence d’un plan
de clivage net. Dans ce cas, la décortication peut être partielle
avec des résultats hémodynamiques moins bons et un risque
de récidive.
Les résultats immédiats sont caractérisés par une nette
amélioration fonctionnelle de l’ordre de 80 à 90% des cas.
La mortalité hospitalière est d’environ 10%. Le risque de
survenue d’une défaillance cardiaque congestive après une
péricardectomie est de 10 à 35% des cas17.
Traitement
Conclusion
Références
1. Shabetai R. The physiopathology of cardiac tamponade and
constriction. In: Spodick DH ed. Pericardialdisease. Philadelphia : FA
Davis, 1976.
2. Shabetai R et al. The hemodynamics of cardiac tamponade and
constrictive pericarditis. Am J Cardiol 1970; 26: 480- 489.
3. Strang JI, Kakaza HH et al. Controlled trial of prednisolone as an adjunct
therapy of tuberculous constrictive pericarditis. Circulation 1987; 76:
363- 391.
4. Ng AS, Dorosti K, Sheldon WC. Constrictive pericarditis following
cardiac surgery. Cleveland Clin Q 1984; 51: 39-45.
5. Kanakis C, Sheikh Al et al. Constrictive pericardial disease following
mitral valve replacement. Chest 1981; 79 : 593-594.
6. Soulen RL, Stark DD et al. Magnetic resonance imaging of constrictive
pericardial disease. Am J Cardiol 1985; 55: 480-484.
7. Chappuiss MA, Kaeser P, et al. Péricardites et autres atteintes
cardiaques, conséquences tardives de la radiothérapie. Rev Med
Suisse Romande 1996 ; 116 : 429-439.
8. Hirschmann JV. Pericardial constriction. Am Heart J 1978 ; 96 : 110-
122
9. Schiavone WA. The changing etiology of constrictive pericarditis in a
large referal center. Am J Cardiol 1986; 58: 373-375.
10. Wann LS, Weyman AE, et al. Premature pulmonary valve opening.
Circulation 1977 ; 55 : 128-133.
11. Oh JK, Hatle LK, Seward JB et al. Diagnostic role of Doppler
echocardiography in constrictive pericarditis. J Am Coll Cardiol 1994;
23: 154-62.
12. Garcia MJ, Rodriguez L, Ares M et al. Differenciation of constrictive
pericarditis from restrictive cardiomyopathy: assessement of left
ventricular diastolic velocities in longitudinal axis by DTI. J Am Coll
Cardiol 1996; 27: 108-14.
13. Tomotsugu T, James D. Thomas, Allan L. Klein. Pulmonary venous
flow by Doppler echocardiography : revisisted 12 years later. J Am Coll
Cardiol. 2003;41(8):1243-1250.
14. McManus BM, Bren GB et al. Hemodynamic cardiac constriction
without anatomic myocardial restriction or pericardial constriction. Am
Heart J 1981; 102: 134- 136.
15. IsnerJM, Carter BL, Bankoff MS et al. Differenciation of constrictive
pericarditis from restrictive cardiomyopathy by computed tomography
imaging. Am J Heart 1983; 105 (6): 1019-25.
16. Langlard J-M. Cardiomyopathies restrictives. EMC-Cardiologie
Angéiologie 2004; 256–270.
17. Seifer F et al. Surgical treatment of constrictive pericarditis. Circulation
1985; 72: 264- 273.
le plus important reste la suspicion clinique devant des
signes d’insufsance cardiaque droite non expliqués par une
pathologie pulmonaire ou une cardiopathie gauche.
N. El Khorb et al Mor J Cardiol 2012; 7:16-20
20
1
/
5
100%