TP : Rôle(s) de l`eau dans le traitement d`un brut

XXVIIIèmes Olympiades de la Chimie
Thème : " Chimie et eau"
Académie de Besançon
TP : Rôle(s) de l’eau dans le traitement d’un brut réactionnel
(d’après un TP des olympiades de chimie de l’académie d’Aix-Marseille)
Introduction :
De part ses propriétés chimiques, l’eau peut réagir avec certaines espèces et être utilisée
comme réactif (réaction d’hydrolyse). Elle peut aussi être un produit de réaction (lors d’une
estérification, par exemple).
Mais même lorsque l’eau ne figure pas dans le bilan d’une réaction, elle apparait presque
toujours dans une ou plusieurs étapes d’une synthèse organique.
Dans certains cas, elle est utilisée dès le lancement de la réaction comme solvant ou co-
solvant. Ce n’est pas le cas le plus courant car beaucoup d’espèces organiques sont peu ou
pas solubles dans l’eau. En revanche, on travaille souvent avec des milieux réactionnels bi-
phasiques (si l’un des réactifs est soluble dans l’eau).
Par ailleurs, quel que soit le cas dans lequel on se trouve, il peut s’avérer utile d’ajouter de
l’eau en fin de synthèse pour figer la réaction par refroidissement et dilution du milieu
réactionnel : il s’agit d’une trempe.
Enfin, dans presque toutes les synthèses, le souci d’améliorer le rendement et la pureté du
produit conduit à effectuer divers traitements comme des lavages de phases organiques à
l’aide de solutions aqueuses, ou des extractions de phases aqueuses à l’aide de solvants
organiques appropriés.
Dans tous ces cas, ce sont les propriétés physiques de l’eau qui sont utilisées (solubilité,
densité, miscibilité). Il convient donc d’analyser à chaque étape d’une synthèse la constitution
du milieu réactionnel : de connaître les propriétés et la nature des espèces présentes
(organiques, minérales, ioniques) afin de prévoir la coexistence de différentes phases et de
savoir où vont se trouver les espèces chimiques attendues.
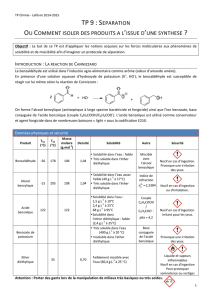
Application à la réaction de Cannizzaro :
La réaction de Cannizzaro(1826-1910) est la réaction de dismutation, en milieu très basique,
des aldéhydes n’ayant pas d’atome d’hydrogène sur l’atome de carbone lié au groupe
carbonyle. Elle conduit à la synthèse de l’alcool et de l’acide correspondants.
La réaction étudiée ici, réalisée sur le benzaldéhyde, est longue.
Benzaldéhyde Ion benzoate Alcool benzylique
Remarque : Le milieu réactionnel étant très basique, ce n’est pas l’acide qui est directement
produit, mais sa base conjuguée : l’ion benzoate.
Même si le bilan de la réaction n’implique pas d’eau, celle-ci est présente du début de la
réaction, pour constituer le milieu bi-phasique, à la fin du traitement pour la purification de
l’acide benzoïque produit par recristallisation dans l’eau chaude. Il conviendra donc
d’analyser le rôle de l’eau à chaque étape de la manipulation.

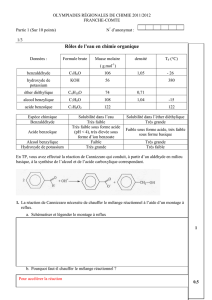
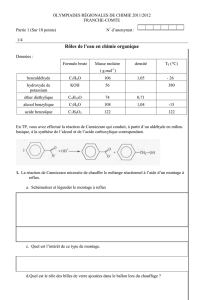
Données physico-chimiques :
Espèce
chimique
Formule
brute
Masse
molaire en
g/mol
Densité
TF (°C)
TEB (°C)
sous pression
normale
Benzaldéhyde
C7H6O
106
1,05
-26
179
Acide
benzoïque
C7H6O2
122
122
241
Alcool
benzylique
C7H8O
108
1,04
-15
205
Hydroxyde
de potassium
KOH
56
380
Ether
diéthylique
C4H10O
74
0,71
34
Espèce chimique
Solubilité dans les solutions
aqueuses
Solubilité dans l’éther
diéthylique
Benzaldéhyde
Très faible
Très grande
Acide benzoïque
Très faible sous forme acide
(pH < 4), très élevée sous
forme d’ion benzoate
Faible sous forme acide, très
faible sous forme basique
Alcool benzylique
Faible
Très grande
Hydroxyde de potassium
Très grande
Très faible
Données relatives aux risques et à la sécurité :
Benzaldéhyde
H302 : Nocif encas d’ingestion
H319 : Provoque une sévère
irritation des yeux
H332 : Nocif par inhalation
H335 : Peut irriter les voies
respiratoires
Acide benzoïque
H318 : Provoque des lésions
oculaires graves
H335 : Peut irriter les voies
respiratoires
Alcool benzylique
H302 : Nocif en cas d’ingestion
H319 : Provoque une sévère
irritation des yeux
H332 : Nocif par inhalation
Hydroxyde de potassium
H302 : Nocif en cas d’ingestion
H314 : Provoque des brûlures de la
peau et des lésions oculaires graves

Ether diéthylique
H224 + EUH019 : Liquide et
vapeurs extrêmement inflammables.
Peut former des peroxydes
explosifs.
H302 : Nocif en cas d’ingestion
H 336 : Peut provoquer somnolence
ou vertiges
EUH066 : L’exposition répétée peut
provoquer dessèchement ou
gerçures
Acide chlorhydrique
H314 : Provoque des brûlures de la
peau et des lésions oculaires graves
H335 : Peut irriter les voies
respiratoires
Cyclohexane
H225 : Liquide et vapeurs très
inflammables
H304 : Peut être mortel en cas
d’ingestion et de pénétration dans
les voies respiratoires
H315 : Provoque une irritation
cutanée
H 336 : Peut provoquer somnolence
ou vertiges
H410 : Très toxique pour les
organismes aquatiques, entraîne des
effets néfastes à long terme
Le port d’une blouse, de lunettes et de gants est obligatoire durant toute la
durée du TP.
Protocole expérimental :
I. Réaction en milieu bi-phasique
Sous la hotte, dans un erlenmeyer refroidi à l’aide d’un bain d’eau glacée, dissoudre
10 g d’hydroxyde de potassium dans 10 mL d’eau distillée (attention : réaction
exothermique).
Une fois que l’hydroxyde de potassium est dissous, transvaser la solution dans un
ballon rodé à fond plat de 100 mL puis ajouter, 10 mL de benzaldéhyde et un barreau
aimanté.
Chauffer le mélange réactionnel et sous agitation à reflux pendant 30 minutes au
moins.
Pendant la durée du chauffage, traiter un maximum de questions de la partie « compte-
rendu ».
II. Traitement et analyse du brut réactionnel
1. Extraction liquide-liquide
Laisser refroidir le milieu réactionnel pendant quelques minutes, y verser 25 mL d’eau
froide puis agiter jusqu’à obtenir la dissolution complète du solide.
Verser le contenu du ballon dans une ampoule à décanter puis ajouter 20 mL d’éther
diéthylique, mélanger les deux phases puis laisser décanter.

Introduire les deux phases dans deux erlenmeyers différents et sécher la phase
organique à l’aide de sulfate de magnésium anhydre.
Analyser chacune des phases par chromatographie sur couche mince. Les dépôts
seront comparés à des échantillons témoins de benzaldéhyde, d’alcool benzylique et
d’acide benzoïque. L’éluant est un mélange cyclohexane/acétone dans les proportions
volumiques 2/1. La plaque sera révélée aux UV.
2. Traitement de la phase aqueuse
Refroidir l’erlenmeyer contenant la phase aqueuse à l’aide du bain d’eau glacée.
Sous la hotte, acidifier le milieu jusqu’à un pH inférieur à 4 avec une solution d’acide
chlorhydrique.
Filtrer le solide obtenu sur entonnoir Büchner.
Casser le vide puis rincer le produit avec deux fois 10 mL d’eau glacée. Essorer à
nouveau le solide puis le sécher entre deux feuilles de papier filtre.
Analyser le solide obtenu par chromatographie sur couche mince. Le dépôt sera
comparé à un échantillon de référence d’acide benzoïque. L’éluant est le même que
précédemment et la plaque sera également révélée aux UV.
3. Purification de l’acide benzoïque par recristallisation
Dans un erlenmeyer de 100 mL préalablement taré, introduire environ 1 g de solide à
purifier.
Ajouter 20 mL d’eau distillée et adapter un réfrigérant à air.
Chauffer le mélange jusqu’à dissolution complète du solide puis laisser refroidir
l’erlenmeyer à l’air libre pendant quelques minutes et, enfin, dans un bain d’eau
glacée.
Filtrer à nouveau le solide sur Büchner.
S’il reste du temps, déterminer la température de fusion des cristaux obtenus à l’aide
du banc Koffler.
Compte-rendu
I.1 Montrer en quoi la réaction de Cannizzaro est une réaction de dismutation.
I.2 Pourquoi refroidit-on l’erlenmeyer dans un bain de glace pour dissoudre l’hydroxyde de
potassium dans l’eau ?
I.3 Au lieu de mélanger directement les pastilles d’hydroxyde de potassium et le
benzaldéhyde, on choisit d’utiliser un milieu bi-phasique. Pourquoi ?

I.4 Déterminer les quantités de matière des deux réactifs et en déduire la nature du réactif
limitant.
I.5 Pourquoi chauffer le milieu réactionnel ?
I.6 Expliquer le rôle du réfrigérant
II.1.1 Pourquoi ajoute-t-on de l’eau au milieu réactionnel après réaction ?
II.1.2 Pourquoi ajoute-t-on de l’éther ensuite ?
II.1.3 Quelles espèces chimiques pourrait-on retrouver dans chacune des phases ?
II.1.4 Représenter le contenu de l’ampoule à décanter et justifier la position relative des
phases.
 6
6
1
/
6
100%