synthese de la 2,6-dibenzilidenecyclohexanone

16/03/2011 Epreuve pratique-ONC 2011 Page 1 sur 8
27èmes OLYMPIADES DE LA CHIMIE 2010-2011
CONCOURS REGIONAL DE L’ACADEMIE DE LYON
Thème : « Chimie et eau »
Université Claude Bernard Lyon 1 Le mercredi 16 mars 2011
- Nom :……………………………………………………….
- Prénom :…………………………………………………….
- Classe, Section :…………………………………………….
- Adresse personnelle ………………………………………...
- N° de téléphone :……………………………………………
- Etablissement :………………………………………………
- Adresse de l'établissement :…………………………………
- Nom du professeur : ………………………………………..
Durée de l’épreuve : 2h30 heures
La feuille de marche est à remplir au fur et à mesure de l’avancée du travail de même que le
compte-rendu
Rôle(s) de l’eau dans le traitement d’un brut
réactionnel
Introduction :
De part ses propriétés chimiques, l’eau peut réagir avec certaines espèces et être utilisée comme réactif
(réaction d’hydrolyse). Elle peut aussi être un produit de réaction (estérification par exemple).
Mais même lorsque l’eau ne figure pas dans le bilan d’une réaction, elle apparait presque toujours dans une ou
plusieurs étapes d’une synthèse organique. Dans certains cas, elle est utilisée dès le lancement de la réaction
comme solvant ou co-solvant. Ce n’est pas le cas le plus courant car beaucoup d’espèces organiques sont peu
ou pas solubles dans l’eau. En revanche, on travaille souvent avec des milieux réactionnels bi-phasiques (si l’un
des réactifs est soluble dans l’eau). Par ailleurs, quelque soit le cas dans lequel on se trouve, il peut s’avérer
utile d’ajouter de l’eau en fin de synthèse pour figer la réaction par refroidissement et dilution du
milieu réactionnel : il s’agit d’une trempe. Enfin, dans presque toutes les synthèses, le souci d’améliorer le
rendement et la pureté du produit conduit à effectuer divers traitements comme des lavages de phases
organiques à l’aide de solutions aqueuses, ou des extractions de phases aqueuses à l’aide de solvants
organiques appropriés.
Dans tous ces cas, ce sont les propriétés physiques de l’eau qui sont utilisées (solubilité, densité, miscibilité).
Il convient donc d’analyser à chaque étape d’une synthèse la constitution du milieu réactionnel : de connaître
les propriétés et la nature des espèces présentes (organiques, minérales, ioniques) afin de prévoir la
coexistence de différentes phases et de savoir où vont se trouver les espèces chimiques attendues.
É
E
ministère
Education
nationale
ÉÉ
E
ministère
Education
nationale

16/03/2011 Epreuve pratique-ONC 2011 Page 2 sur 8
Application à la réaction de Cannizzaro:
Stanislao Cannizzaro, né à Palerme le 13 juillet 1826 et mort à Rome le 10 mai 1910, est un chimiste italien.
La réaction de Cannizzaro est une réaction de dismutation du benzaldéhyde qui a lieu en présence d’ions
hydroxyde.
Même si le bilan de la réaction n’implique pas d’eau, celle-ci est présente du début de la réaction, pour
constituer le milieu bi-phasique, à la fin du traitement pour la purification de l’acide benzoïque produit par
recristallisation dans l’eau chaude. Il conviendra donc d’analyser le rôle de l’eau à chaque étape de la
manipulation.
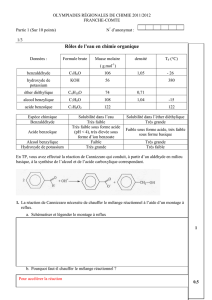
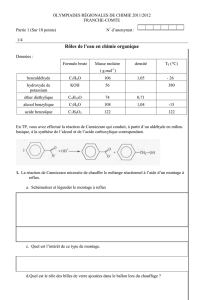
Données utiles :
Formule brute
Masse molaire (g.mol-1)
Densité
Changement d’état
Benzaldéhyde
C7H6O
106,12
1,05
Téb = 179 °C
Acide benzoïque
C7H6O2
122,12
-
Tfus = 121-125 °C
Alcool benzylique
C7H8O
108,14
1,04
Téb = 205 °C
Hydroxyde de potassium
KOH
56,10
-
Tfus = 380 °C
diéthyléther
C4H10O
74,12
0,71
Téb = 35 °C
Masse molaire atomiques : M(H)= 1,0 g.mol-1 ; M(C)= 12,0 g.mol-1 ; M(O)= 16,0 g.mol-1 ; M(K)= 39,1 g.mol-1 ;
Données sur le couple acide benzoïque/ion benzoate : C6H5COOH(aq)/C6H5COO-(aq) : pKA = 4,2
Données relative à la solubilité des composés utilisés :
Composés
Solubilité dans l’eau
Solubilité dans le diéthyléther
benzaldéhyde
Très faible
Très grande
Acide benzoïque
Très faible sous forme acide (pH<4)
élevée sous forme d’ions benzoate
Faible
Très faible
Alcool benzylique
Faible
Très grande
Hydroxyde de potassium
Très grande
Très faible
Données relatives aux risques et à la sécurité :
Notes importantes
Les candidats sont totalement responsables de la gestion du temps, de l’organisation de leur travail
et de l’utilisation des données fournies
Une « feuille de marche » est fournie. Elle sera remplie au fur et à mesure de l’avancée du travail
et comportera toutes les réponses relatives à la partie expérimentale.
L’évaluation porte sur la qualité des gestes expérimentaux, la précision du travail, la compréhension
des principes et phénomènes, le rendement de la synthèse et la qualité du produit obtenu.
TOUT MANQUEMENT AUX REGLES DE SECURITE SERA SEVEREMENT SANCTIONNE.
O
+OH -
OH
+
O
OH
2

16/03/2011 Epreuve pratique-ONC 2011 Page 3 sur 8
Benzaldéhyde
Xn – nocif
R 22 : Nocif en cas d’ingestion
S24 : Eviter le contact avec la peau
Acide benzoïque
Xn – nocif
R 22 : Nocif en cas d’ingestion
R 36 : Irritant pour les yeux
S 26 : En cas de contact avec les yeux, laver immédiatement et abondamment avec de
l’eau et consulter un spécialiste
Alcool benzylique
Xn – nocif
R 20/22 : Nocif par inhalation et par ingestion
S 26 : En cas de contact avec les yeux, laver immédiatement et abondamment avec de
l’eau et consulter un spécialiste
Hydroxyde de
potassium
C-Corrosif
R 22 : Nocif en cas d’ingestion
R 35 : Provoque de graves brûlures
S 26 : En cas de contact avec les yeux, laver immédiatement et abondamment avec de
l’eau et consulter un spécialiste
S 36/37/39 : Porter un vêtement de protection approprié, des gants et un appareil de
protection des yeux/du visage
S 45 : En cas d’accident ou de malaise consulter immédiatement un médecin (si
possible lui montrer l’étiquette)
Diéthyléther
F+ - Extrêmement
inflammable
Xn – nocif
R 12 : Extrêmement inflammable
R 19 : Peut former des peroxydes explosifs
R 22 : Nocif en cas d’ingestion
R 66 : L’exposition répétée peut provoquer dessèchement ou gerçures de la peau
R 67 : L’inhalation de vapeurs peut provoquer somnolence et vertiges
S 9 : Conserver le récipient dans un endroit bien ventilé
S 16 : Conserver à l’écart de toute flamme ou sources d’étincelles – Ne pas fumer.
S 29 : Ne pas jeter les résidus à l’égout
S 33 : Eviter l’accumulation de charges électrostatiques
Dichlorométhane
Xn – nocif
R 40 : Effet cancérogène suspecté
S 2 : Conserver hors de portée des enfants
S 23 : Ne pas respirer les vapeurs
S 24/25 : Eviter le contact avec la peau et les yeux
S 36/37 : Porter un vêtement de protection et des gants appropriés
Acide chlorhydrique
(36%)
C-Corrosif
R 34 : Provoque des brûlures
R 36/37/38 : Irritant pour les yeux, les voies respiratoires et la peau
S 26 : En cas de contact avec les yeux laver immédiatement et abondamment avec de
l’eau et consulter un spécialiste
S 36/39 : Porter un vêtement de protection approprié et un appareil de protection
des yeux/du visage
S 45 : En cas d’accident ou de malaise consulter immédiatement un médecin (si
possible lui montrer l’étiquette)
Le port des lunettes de sécurité est obligatoire pendant toute la durée du TP.
Ne jeter aucun produit à l’évier. Recueillir les produits liquides dans les bidons de
récupération adéquats. Les produits solides seront laissés dans les boites de Pétri.

16/03/2011 Epreuve pratique-ONC 2011 Page 4 sur 8
Protocole expérimental :
Partie I : Réaction en milieu bi-phasique
1. Dissoudre 10 g d’hydroxyde de potassium dans 10 mL d’eau dans un erlenmeyer refroidi à l’aide d’un bain
d’eau glacée.
2. Faire un montage à reflux avec un ballon monocol de 100 mL et un chauffe-ballon muni d’une agitation
magnétique.
3. Une fois le sel dissous, transvaser la solution dans le ballon monocol de 100 mL. Puis ajouter 10 mL de
benzaldéhyde.
4. Porter le milieu réactionnel au reflux en agitant vigoureusement pendant 1h00.
5. Consigner sur la feuille de marche les observations sur l’évolution du milieu réactionnel lors du chauffage
et répondre aux questions du compte-rendu.
Partie II : Traitement du brut réactionnel
1 – Analyse du brut réactionnel
6. Laisser refroidir le milieu réactionnel puis y verser entre 15 et 25 mL d’eau jusqu’à obtenir une solution
homogène.
7. Introduire la solution dans une ampoule à décanter.
8. Récupérer chacune des phases dans un erlenmeyer.
9. Analyser la phase aqueuse et la phase organique ainsi obtenues par chromatographie sur couche mince
(CCM). Le dépôt sera comparé au
benzaldéhyde de départ, ainsi qu’à des échantillons de référence d’alcool
benzylique et d’acide benzoïque (tous trois en solution dans le diéthyléther à disposition dans la salle).
L’éluant utilisé est un mélange cyclohexane/diéthyléther dans les proportions volumiques 1/1 (à
disposition). La plaque pourra être révélée aux UV dans un premier temps puis par un révélateur chimique
(solution de permanganate de potassium)
2 – Extraction et identification de l’alcool benzylique
10. Extraire la phase aqueuse obtenue avec trois portions de 30 mL de diéthyléther. Conserver la phase
aqueuse !
11. Sécher la phase organique à l’aide de sulfate de magnésium anhydre puis la filtrer sur un entonnoir en
verre muni d’un petit morceau de coton.
12. Recueillir le filtrat dans un ballon de 250 mL préalablement taré et évaporer le solvant à l’aide d’un
évaporateur rotatif.
13. Déterminer la masse m1 de produit ainsi obtenu.
14. Si l’alcool benzylique obtenu est d’une pureté suffisante, on peut le caractériser par spectroscopie Infra-
Rouge. Consigner les résultats sur la feuille de marche.
3 – Séparation et identification de l’acide benzoïque
15. Placer la phase aqueuse dans un erlenmeyer puis la refroidir à l’aide d’un bain d’eau glacée.
16. L’acidifier sous la hotte jusqu’à un pH inférieur à 4 à l’aide d’acide chlorhydrique à 36%.
17. Réaliser le montage de filtration sous pression réduite.
18. Filtrer et essorer le solide sur verre fritté. Le rincer 2 fois avec 5 mL d’eau glacée puis le sécher à l’aide
d’un morceau de papier filtre.
19. Déterminer la masse m2 de solide ainsi obtenu.
20. Analyser le produit obtenu par chromatographie sur couche mince (CCM). Le dépôt sera comparé à un
échantillon de référence d’acide benzoïque. L’éluant utilisé est le même que celui utilisé précédemment
(mélange cyclohexane/diéthyléther dans les proportions volumiques 1/1 (à disposition)). La plaque pourra
être révélée aux UV dans un premier temps puis par un révélateur chimique (solution de permanganate de
potassium)

16/03/2011 Epreuve pratique-ONC 2011 Page 5 sur 8
Partie III : Purification de l’acide benzoïque
Comme le solide obtenu n’est pas pur (ce qui peut être confirmé par la mesure de la température de fusion),
on se propose dans cette partie de le purifier.
21. Dans un bécher de 100 mL, introduire autour de 1,5 g de solide à purifier puis la petite branche de sapin.
Poser la coupelle de verre sur le bécher et déposer de la glace sur cette coupelle.
22. Poser le bécher sur une plaque chauffante et régler la température à environ 100°C (pas plus).
23. Observer et expliquer ce qui se produit dans le bécher (questions 3 du compte-rendu).
********************************************FIN************************************************
Compte Rendu :
Partie I : Réaction en milieu bi-phasique
Barême
Points
1.1. Pourquoi refroidit-on l’erlenmeyer dans un bain de glace pour dissoudre l’hydroxyde de
potassium dans l’eau ?
/1
1.2. Au lieu de mélanger directement les pastilles d’hydroxyde de potassium et le
benzaldéhyde, on choisit d’utiliser un milieu bi-phasique, pourquoi ?
/1
1.3. Déterminer la quantité de matière du réactif limitant :
n =
/2
1.4. Quel est le rôle du chauffage ?
/1
1.5. Quel est le rôle du réfrigérant ? Préciser le principe du réfrigérant utilisé.
/1+/1
1.6. Pourquoi doit-on agiter « vigoureusement » le milieu ?
/1
1.7. Consigner les observations relatives à l’évolution du milieu réactionnel.
/2
 6
6
 7
7
 8
8
1
/
8
100%