Introduction à la synthèse organique T.P. de chimie organique 1

Introduion à la synthèse organique T.P. de imie organique
1. Avant le TP
A l’aide du mode opératoire de synthèse détaillé ci-dessous, remplir un tableau d’engagement pour la réaion de
Cannizzro et identier le réaif limitant. Notons que toutes les cases ne sont pas nécessairement remplies.
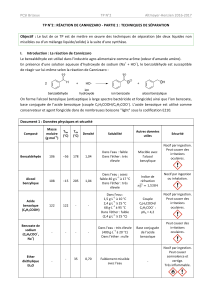
Réaifs État m V M d n Éq
physique /g /mL /g·mol−1/mmol
Benzaldéhyde liquide 3 106,0 1,05 29,7 1
Potasse solide 4 56,1 71,3 2,4
En eet :
nbenzaldéhyde =m
M=ρ V
M=d ρeauV
M
A.N.
nbenzaldéhyde =1,05 ×1·103×3·10−3
106,0= 29,7mmol
nKOH =m
M
A.N.
nKOH =4
56,1= 71,3mmol
soit 71,3/29,72,4 équivalents de potasse pour 1 équivalent de benzaldéhyde. Or deux molécules de benzaldéhyde ré-
agissent avec une molécule de potasse : la potasse e donc en excès. Le benzaldéhyde e le réaif limitant.
2. Reproduire ci-dessous la plaque CCM, calculer les rapports frontaux et interpréter.
Le milieu réaionnel contient encore du benzaldéhyde (Rf = 0,6) qui n’a pas ni de réagir et de l’alcool benzylique (Rf =
0,3) produit.
Lycée Sainte Geneviève 1 2015-2016

Introduion à la synthèse organique T.P. de imie organique
3. Reproduire ci-dessous la plaque CCM, calculer les rapports frontaux et interpréter.
Le milieu réaionnel ne contient que de l’alcool benzylique (et de l’acide benzoïque non mis en évidence ici) et plus une
trace de benzaldéhyde qui a complètement réagi.
Remarque : le benzaldéhyde peut aussi montrer une tache plus base correspondant à de l’acide benzoïque qui e le produit
d’oxydation par l’air du benzaldéhyde.
4. Au regard de ce que contient le brut réaionnel, pouvez vous le qualier de phase aqueuse ou organique ?
Le brut réaionnel contient majoritairement de l’eau. Il e donc naturellement qualié de phase aqueuse.
5. Pourquoi l’alcool benzylique peut-il être extrait avec de l’éther diéthylique. Parallèlement, pourquoi l’ion benzoate
ree-t-il en solution aqueuse ?
L’alcool benzylique e une molécule neutre globalement peu polaire. Elle e donc bien soluble dans un solvant peu polaire
comme l’e le diéthyléther. A contrario, l’ion benzoate e argé : il e donc particulièrement polaire et donc soluble
dans un solvant très polaire comme l’eau.
6. À quel gaz pouvez-vous attribuer la surpression observée lors de l’extraion ?
La surpression peut être aribuée à de l’éther gazeux. En eet ce dernier se vaporise partiellement pour plusieurs raisons :
• les mains posées sur l’ampoule augmente la température intérieure ;
• l’agitation de la solution augmente l’agitation thermique et donc la température à l’intérieur de l’ampoule.
7. Pourquoi e-il nécessaire de laver la phase organique avec de l’eau ?
Pour débarasser la phase organique des traces d’ion benzoate qui pourraient encore y être emprisonnées.
8. Calculer la masse d’alcool benzylique théoriquement produit par la réaion. En déduire le rendement de la réaion
en alcool benzylique.
Lycée Sainte Geneviève 2 2015-2016

Introduion à la synthèse organique T.P. de imie organique
3 mL de benzaldéhyde ont été introduit. Cela correspond à une quantité de matière nbenzaldéhyde :
nbenzaldéhyde =mbenzaldéhyde
Mbenzaldéhyde
=Vbenzaldéhydedbenzaldéhydeρeau
Mbenzaldéhyde
A.N.
nbenzaldéhyde =3 10−3×1,05 ×1
7×12 + 6 ×1+1×16 = 2,97 10−2mol
En considérant la réaion totale on peut déterminer la masse d’alcool benzylique théoriquement formé mthéo
alcool :
mthéo
alcool =nthéo
alcool Malcool =nbenzaldéhyde Malcool
2
A.N.
mthéo
alcool =2,97 10−2×(7 ×12 + 8 ×1+1×16)
2= 1,6g
Attention : il ne faut pas oublier qu’à partir d’un benzaldéhyde on forme 1/2 alcool benzylique.
Pour calculer le rendement en alcool benzylique, il sut de diviser la masse trouvée par la masse théorique.
9. elle réaion se produit lors de l’acidication du milieu ? En donner l’équation-bilan. Pourquoi l’espèce formée
précipite-t-elle alors que l’espèce initiale e able en solution ?
La réaion e la réaion acido-basique entre l’acide lorhydrique concentré et l’ion benzoate :
PhCOO−+HCl =PhCOOH +Cl−
On forme alors l’acide benzoïque qui n’e plus une espèce argée. Il e donc moins polaire que l’ion benzoate et e
moins abilisé par un solvant polaire comme l’eau. Il précipite alors sous forme d’un solide blanc.
10. elle e la valeur du pH relevé ? E-ce logique ?
On mesure un pH d’environ 1. En eet, on a acidié la solution sous la valeur du pKa pour voir apparaitre majoritairement
l’acide benzoïque.
11. Calculer la masse de composé théoriquement produit par la réaion. En déduire le rendement de la réaion en
acide benzoïque.
La masse théorique d’acide benzoïque mthéo
acide e :
mthéo
acide =nthéo
acide Macide =nbenzaldéhyde Macide
2
A.N.
mthéo
acide =2,97 10−2×(7 ×12 + 6 ×1+2×16)
2= 1,81 g
Pour calculer le rendement en acide benzoïque, il sut de diviser la masse trouvée par la masse théorique.
12. el produit étalon avez vous utilisé ?
L’étalon utilisé e l’acetanilide car sa température de fusion (114,5 ℃) e proe de celle de l’acide benzoïque (122 ℃).
13. el température de fusion avez vous trouvée ? Conclure quant à la pureté du produit.
La température de fusion mesurée e de 121 ℃. Comme la mesure de la température à l’aide d’un banc Koer e précise
à 2 ° près, on peut considérer que le produit teé e pur.
14. En annexe sont fournis les speres IR et RMN 1Hdes réaifs et des produits. Attribuer à aque molécule son
spere en juiant.
Lycée Sainte Geneviève 3 2015-2016

Introduion à la synthèse organique T.P. de imie organique
Speres infrarouges : seul le spere A ne présente pas de bande large au de la de 3000 cm−1caraériique d’un H
engagé dans une liaison H. De plus il présente une bande ne et intense vers 1700 cm−1correspondant à une liaison
C=O. Ce spere e donc celui du benzaldéhyde.
Le spere C ne possède pas cee bande vers 1700 cm−1: il s’agit donc de l’alcool benzylique.
Enn la spere B possède à la fois la bande caraériique de la liaison C=O et une bande large caraériique d’un
proton engagé dans une liaison H : si s’agit de l’acide benzoïque.
Speres de R.M.N. : le spere A présente un signal élargi vers 4,7ppm qui e caraériique de protons portés par un
carbone tétravalent. On peut eimer que ce signal e caraériique du CH2de l’alcool benzylique ; il e couplé avec le
proton du groupement hydroxyle. Le signal e mal résolu, ce qui lui donne l’aspe d’un singulet. Le spere A e donc
celui de l’alcool benzylique.
Le spere B présente un pic vers 10 ppm caraériique d’un proton d’aldéhyde : c’e le spere du benzaldéhyde.
Par élimination, le spere C e celui de l’acide benzoïque.
Lycée Sainte Geneviève 4 2015-2016
1
/
4
100%