5Diagrammes d`Ellingham

Diagrammes d’Ellingham (chimie 5) 1
Les métaux, à l’état de corps simples sont particulièrement utiles pour leurs propriétés mécaniques et électriques par
exemple.
Malheureusement, à l’état naturel (c’est-à-dire dans la croûte terrestre), ils n’existent la plupart du temps que sous forme
oxydée dans des corps composés tels qu’oxydes, halogénures, carbonates, phosphates, sulfures, sulfates,
nitrates… (exemples : Al
2
O
3
, Fe
2
O
3
, ZnS, FeCO
3
…). Ceci est la conséquence de la facile oxydation des éléments
métalliques par le dioxygène de l’air.
Il est donc nécessaire d’opérer une réduction (pour passer par exemple de ZnS à Zn, de FeCO
3
à Fe). Celle-ci peut se faire
par voie sèche (objet de ce chapitre) ou par voie humide (chapitre suivant).
Le diagramme d’Ellingham est un outil précieux pour la compréhension des principes de cette réduction.
I. Construction d’un diagramme d’Ellingham
1. Réaction d’obtention d’un oxyde
De très nombreux métaux et des non-métaux (B, S, P, C, Si) brûlent dans le dioxygène par des réactions très souvent
exothermiques, appelées réactions de combustion.
Les diagrammes d’Ellingham permettent de comparer ces diverses réactions avec l’oxygène de l’air. On convient d’écrire
les équations bilans avec un coefficient stœchiométrique pour O
2
égal à 1 ou 1/2. Les deux conventions sont utilisées, mais
on doit bien sûr fixer son choix pour une étude donnée : nous choisissons dans ce cours le coefficient 1.
réaction d’obtention de l’oxyde M
x
O
y
à partir du dioxygène gazeux O
2
:
)g(2
OM
y
x
2+
⇌
yx
OM
y
2
Le sens direct est le sens de l’oxydation du métal (i.e. de sa corrosion), le sens inverse est le sens de la réduction de
l’oxyde.
Dans le sens direct, le n.o. de l’élément M augmente, on dit que M est oxydé en M
x
O
y
par O
2
(lequel est un oxydant); le
n.o. de l’élément oxygène diminue (passe de O à –II), on dit qu’il est réduit par M lequel est un réducteur. On dit que
M
x
O
y
/M forme un couple oxydant/ réducteur. O
2
/ M
x
O
y
en est un autre. La réaction de formation de l’oxyde est une
réaction d’oxydoréduction.
Exemples :
2Zn
sol
+O
2(g)
⇌ 2ZnO
sol
2Zn
liq
+O
2(g)
⇌2ZnO
sol
(4/3)Fe
sol
+O
2(g)
⇌ (2/3)Fe
2
O
3,sol
2. Approximation d’Ellingham
L’enthalpie libre standard d’une telle réaction s’écrit :
°ν=°∆
°∆ν=°∆
°∆−°∆=°∆
∑
∑
)T(s)T(S
)T(H)T(H
avec)T(ST)T(H)T(G
jjr
jfjr
rrr
somme sur tous les constituants
DIAGRAMMES D’ELLINGHAM

Diagrammes d’Ellingham (chimie 5) 2
Les tables de données thermodynamiques donnent les valeurs des enthalpies standard de formation et des entropies
molaires standard à la température T°=298,15K. Les valeurs des grandeurs de réaction à une température T différente de
T° s’obtiennent généralement à l’aide des relations de Kirchhoff, mais souvent, le terme correctif par rapport aux
grandeurs de réaction à T°, sont négligeables :
0
T
)T(C
dT
)]T(S[d
et0)T(C
dT
)]T(H[d
pr
r
pr
r
≈
°∆
=
°∆
≈°∆=
°∆
On appelle approximation d’Ellingham, l’approximation consistant à considérer que, sur des intervalles de température
où les constituants ne changent pas d’état, l’enthalpie et l’entropie standard de réaction ne dépendent pas de la température
)T(ST)T(H)T(Goù'd
)T(S)T(S
)T(H)T(H
rrr
rr
rr
°°∆−°°∆=°∆
°°∆≈°∆ °°∆≈°∆
: fonction affine de la température
Sur tout intervalle où aucun changement de phase ne se produit, l’enthalpie libre standard est une fonction affine de la
température.
3. Diagramme d’Ellingham
On appelle diagramme d’Ellingham d’un couple oxydant-réducteur M
x
O
y
/M, le graphe de ∆
r
G°=∆
r
H°-T∆
r
S°=f(T) en
fonction de la température T (T compris en général entre 300 et 3000K).
Dans un intervalle de température où M et M
x
O
y
ne changent pas d’état physique, le diagramme d’Ellingham du couple est
formé d’un segment de droite (dans l’approximation d’Ellingham). Son ordonnée à l’origine est ∆
r
H°, sa pente est (-∆
r
S°).
Les réactions étant exothermiques, les ∆
r
H° sont négatifs.
Au passage par une température de changement d’état de M ou M
x
O
y
, ∆
r
H° et ∆
r
S° changent, mais ∆
r
G°(T) est une
fonction continue de la température : le diagramme d’Ellingham d’un couple est une succession continue de segments de
droite.
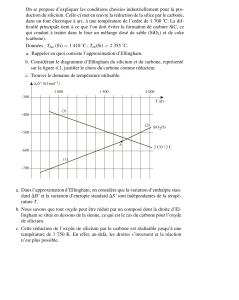
4. Exemple : diagramme d’Ellingham du zinc
Les données sont les suivantes : T
F
=693K (température de fusion du zinc), L
F
=∆
fus
H°=6,7kJ/mol (enthalpie molaire de
fusion du zinc; T
E
=1180K (température d’ébullition du zinc), L
E
=∆
vap
H° =114,8kJ/mol (enthalpie molaire d’ébullition).
Zn(cr) ZnO(cr) O
2
(g)
∆
f
H° en kJ/mol 0 -350,5 0
S° en J/K/mol 41,6 43,6 205
• Pour T<693K, la réaction d’obtention de l’oxyde s’écrit :
(1) 2Zn(cr)+O
2
(g) ⇌ 2ZnO(cr) correspondant au couple ZnO(cr)/Zn(cr) (notation (cr) : cristallin)
On calcule : ∆
r
G°
1
(T)=-701+0,201T en kJ/mol
• Pour 693K<T<1180K La réaction d’obtention de l’oxyde s’écrit :
(1’) 2Zn(l)+O
2
(g) ⇌ 2ZnO(cr) correspondant au couple ZnO(cr)/Zn(l) (notation (l) : liquide)
(1’)=(1)-2(α) avec
)l(Zn)cr(Zn)(
←
→
α
équilibre de fusion du zinc
1r
1
F1rr1r'1r
Hmol.kJ4,714L2HH2HH °∆<−=−°∆=°∆−°∆=°∆
−
α

Diagrammes d’Ellingham (chimie 5) 3
1r
11
F
F
1rr1r'1r
Smol.K.kJ2204,0
T
L
2SS2SS °∆<−=−°∆=°∆−°∆=°∆
−−
α
T2204,04,714)T(G
'1r
+−=°∆
(
1
mol.kJ
−
)
Au passage par une température de changement d’état, la courbe d’Ellingham ∆
r
G°(T) du couple M
x
O
y
/M est continue (du
au fait que les potentiels chimiques des deux phases concernées sont identiques à la température de changement d’état),
mais présente un point anguleux : la pente elle, subit une discontinuité (ici pente(1’)>pente(1)).
• Pour T>1180K. La réaction d’obtention de l’oxyde s’écrit :
)cr(ZnO2O)g(Zn2)"1(
2←
→
+
(notation (g) : gazeux)
(1’’)=(1’)-2(β) avec
)g(Zn)l(Zn)(
←
→
β
équilibre d’ébullition du zinc
1
''1r
1r
11
E
E
'1rr'1r''1r
'1r
1
E'1rr'1r''1r
mol.kJenT415,0944)T(G
Smol.K.kJ415,0
T
L
2SS2SS
Hmol.kJ944L2HH2HH
−
−−
β
−
β
+−=°∆
°∆<−=−°∆=°∆−°∆=°∆
°∆<−=−°∆=°∆−°∆=°∆
On déduit le diagramme d’Ellingham du zinc :
5. Propriétés de la pente
)M(s
y
x2
)O(s)OM(s
y
2
S
2yxr
°−°−°=°∆
:
a) Ordre de grandeur
Si réducteur et oxydant sont tous deux solides ou liquides, leur entropie molaire standard est faible devant celle du
dioxygène :
Si réducteur et oxydant sont tous deux solides ou liquides :
°∆ S
r
#
°−
2
O
s
# -200JK
-1
.mol
-1
Les droites d’Ellingham relatives aux différents couples Ox/Red sont souvent sensiblement parallèles et leur pente vaut
environ 200 SI (200 avec le choix d’un coefficient 1 pour O
2
, ce serait 100 si on avait choisi un coefficient 1/2).
b) Changement de pente au passage par une température de changement
d’état
• Changement d’état du corps simple M (transition allotropique T, fusion F, ébullition E)

Diagrammes d’Ellingham (chimie 5) 4
Lorsque par élévation de température, le corps simple M change d’état physique, la courbe d’Ellingham ∆
r
G°(T) du couple
M
x
O
y
/M présente un point anguleux avec accroissement de la pente : s°(M) plus grand, ∆
r
S° plus faible, pente plus grande.
• Changement d’état de l’oxyde (transition allotropique t, fusion f, ébullition e)
Lorsque par élévation de température l’oxyde change d’état physique, la courbe d’Ellingham ∆
r
G°(T) du couple M
x
O
y
/M
présente un point anguleux avec décroissance de la pente : s°(M
x
O
y
) plus grand, ∆
r
S° plus grande, pente plus faible.
6. Pression de corrosion
On dit qu’un métal subit une corrosion sèche, s’il est oxydé par le dioxygène gazeux O
2(g)
.
On se limite au cas où métal et oxyde sont tous deux à l’état condensé.
Soit l’équilibre d’obtention de l’oxyde : (Eq)
)g(2
OM
y
x
2+
⇌
yx
OM
y
2
La réaction de corrosion proprement dite est la réaction dans le sens direct bien sûr.
La constante de l’équilibre (Eq) s’écrit, les activités des phases condensées valant 1 :
°∆
−=
°
=° RT
)T(G
exp
PP
)T(K
r
éq,O
2
.
A une température donnée, l’équilibre n’est réalisé que pour une valeur particulière de la pression partielle en O
2
: celle
vérifiant la relation ci-dessus. Cette pression partielle en O
2
imposée par l’équilibre pour la température T s’appelle la
pression de corrosion du métal M à la température T.
La pression de corrosion du métal M à la température T est la pression partielle de O
2
pour laquelle on a l’équilibre (Eq)
°∆
°=
°
°
== RT
)T(G
expP
K
P
)T(P)T(P
r
éq,Ocor
2
Nous allons montrer que si la pression en dioxygène est supérieure à la pression de corrosion du métal, celui-ci est
corrodé.
II. Utilisation
1. Domaines de stabilité
Soit un couple M
x
O
y
/M caractérisé par (Eq)
)g(2
OM
y
x
2+
⇌
yx
OM
y
2
La courbe ∆
r
G°(T) partage le plan en deux parties. Il est intéressant de préciser la signification des deux régions ainsi
définies.
a) Red et Ox sont tous deux à l’état condensé
Soit P
O2
la pression partielle en O
2
(dans les conditions ambiantes usuelles, P
O2
=0,2bar). On se pose la question : « quel est
l’état stable sous lequel se trouve l’élément M pour une telle pression : forme métallique ou forme oxydée? ». Traçons
dans le diagramme d’Ellingham, la droite d’équation :
y(T)=RTln(P
O2
/P°)=-RTlnQ où Q est le quotient de réaction de (Eq)
La droite y(T) passe par l’origine. Dans les conditions usuelles, P
O2
<P° : sa pente est négative.
y(T) et ∆
r
G°(T) ont même dimension, on peut les comparer (on les trace sur le même diagramme).

Diagrammes d’Ellingham (chimie 5) 5
Supposons que, sous la pression P
O2
, à une température T, on ait :
• y(T)> ∆
r
G°(T) : le point représentatif du système est au-dessus de la courbe d’Ellingham (point M
1
)
⇔
°<⇔>⇔>
°
⇔°−>−⇔>⇔
°
>
°KQ00
Q
K
lnRTKlnRTQlnRTPP
P
P
lnRT
P
P
lnRT
corO
cor
O
2
2
A
Ce cas correspond donc à une pression de travail P
O2
supérieure à la pression de corrosion.
Les équivalences ci-dessus montrent qu’alors l’affinité chimique du système pour la réaction de corrosion est
positive : l’équilibre (Eq) n’est pas réalisé, il y a réaction dans le sens direct, i.e. le sens de la corrosion : le métal M
est oxydé.
Cette réaction se poursuit tant que l’affinité est positive. Or l’affinité reste constante et égale à RTln(P
O2
/P
cor
) puisque
la pression P
O2
est imposée. La réaction a donc lieu jusqu’à épuisement du métal : on ne peut pas obtenir l’équilibre
chimique (Eq) (à T fixée, l’équilibre ne peut avoir lieu que pour P
O2
=P
cor
).
La région située au-dessus de la courbe d’Ellingham correspond donc à des états où seul l’oxyde M
x
O
y
existe : c’est le
domaine d’existence exclusive de l’oxyde (aussi appelé domaine de stabilité de l’oxyde).
• y(T)< ∆
r
G°(T) : le point représentatif du système est au-dessous de la courbe d’Ellingham (point M
2
).
⇔
°>⇔<⇔<
°
⇔°−<−⇔<⇔
°
<
°KQ00
Q
K
lnRTKlnRTQlnRTPP
P
P
lnRT
P
P
lnRT
corO
cor
O
2
2
A
Ce cas correspond donc à une pression de travail P
O2
inférieure à la pression de corrosion.
Les équivalences ci-dessus montrent qu’alors l’affinité chimique du système pour la réaction de corrosion est
négative : c’est la réaction de réduction de l’oxyde qui a donc lieu (sens inverse) : l’oxyde est réduit en métal M.
Cette réaction se poursuit tant que l’affinité est négative. Or l’affinité reste constante et égale à RTln(P
O2
/P
cor
) puisque
la pression P
O2
est imposée. La réaction a donc lieu jusqu’à épuisement de l’oxyde : on ne peut pas obtenir l’équilibre
chimique (Eq).
La région située au-dessous de la courbe d’Ellingham correspond donc à des états où seul le métal M existe : c’est le
domaine d’existence exclusive (ou domaine de stabilité) du métal.
• y(T)= ∆
r
G°(T) : le point représentatif du système est sur la courbe d’Ellingham (point M
e
).
°=⇔=⇔=
°
⇔°−=−⇔=⇔
°
=
°KQ00
Q
K
lnRTKlnRTQlnRTPP
P
P
lnRT
P
P
lnRT
corO
cor
O
2
2
A
Ce cas correspond donc à une pression de travail P
O2
égale à la pression de corrosion. On vient de démontrer qu’on a
alors l’équilibre (Eq).
La courbe d’Ellingham est donc le lieu des états où l’équilibre chimique (Eq) est réalisé (avec présence simultanée de
l’oxyde et du métal).
T
0
∆
rG°(T)
y(T) cas (2)
y(T) cas (1)
M
1
M
e
M
2
Domaine de
stabilité du métal
Domaine de
stabilité de l’oxyde
Lieu de l’équilibre
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%