Ellingham, diagramme d` - chimie. - Devoir-de

Ellingham, diagramme d' - chimie.
1
PRÉSENTATION
Ellingham, diagramme d', graphique représentant, pour un couple métal-oxyde donné, la variation de l’énergie libre standard en fonction de la température, pour la réaction d’oxydation du métal par une mole d’oxygène. Le diagramme d’Ellingham
peut également être tracé pour une demi-mole de dioxygène impliquée.
2
DESCRIPTION
La stabilité d’un corps simple dans l’atmosphère ou l’élaboration d’un métal à partir de l’un de ses oxydes dépend de critères thermodynamiques. Soit M un métal et MxOy l’un de ses oxydes, x et y étant deux entiers naturels. L’équation-bilan de
l’oxydation du métal M en MxOy par une mole de dioxygène est :
On note ΔG° la variation de l’enthalpie libre standard (mesurée pour les solides et les liquides purs, sous une pression de 1 atm) de la réaction (dans le sens 1), rapportée à une mole de dioxygène. On a ΔG° = ΔH° - TΔS°, où ΔH° est la variation de
l’enthalpie standard, ΔS°, la variation de l’entropie standard et T la température absolue. On considère que ΔH° et ΔS° sont approximativement constantes dans un large domaine de température (approximation d’Ellingham). Ainsi, la représentation
graphique de ΔG° = f(T) est une droite d’ordonnée à l’origine ΔH° et de pente - TΔS°, tant qu’il n’y a pas changement de phase (fusion, par exemple) de l’oxyde ou du métal ; dans le cas contraire, la pente de la droite se modifie brutalement à la
température de la transformation physique. Pour les valeurs de ΔS° et ΔH°, on utilise celles mesurées à 298 K (25 °C), fournies dans des tables.
Pour la plupart des métaux, la réaction d’oxydation est exothermique, ce qui signifie que ΔH° < 0. En ce qui concerne les métaux très électropositifs, tels que le sodium ou le magnésium, l’oxydation est très exothermique. On peut alors considérer
que TΔS° est négligeable devant ΔH°, et on a alors ΔG° < 0, ce qui implique que la réaction d’oxydation du métal est quasi totale dans le sens 1 : il n’existe pas d’équilibre chimique. Précisons que, dans tous les cas, ΔG° < 0.
L’entropie S est une mesure du désordre. Pour un couple métal / oxyde solides — ce qui correspond à la plupart des cas aux températures usuelles —, la variation de l’entropie standard de la réaction est négative, car au cours de l’oxydation il y a
disparition d’une mole d’oxygène (gazeux), donc évolution du système vers un ordre plus important (l’état gazeux étant le plus désordonné des trois phases possibles de la matière). La pente de la droite ΔG° = f(T) est alors positive.
La constante d’équilibre K de la réaction à la température T vérifie :
La relation ci-dessus permet de calculer la pression de l’oxygène nécessaire à une réaction quantitative, ou totale (voir réaction chimique).
3
RÉDUCTION DES OXYDES
3.1
Superposition des diagrammes
Un oxyde est un composé binaire contenant de l’oxygène associé à un métal ou à un radical. Le diagramme d’Ellingham précise l’affinité thermodynamique d’un métal pour l’oxygène. Ainsi, on peut superposer les différents diagrammes d’Ellingham de
plusieurs couples métal / oxyde ramenés à une mole de dioxygène. On remarque alors que les droites sont sensiblement parallèles pour les températures assez faibles. En effet, la variation de l’entropie standard ne dépend que de l’évolution du
système réactionnel, vers l’ordre ou le désordre. Comme dans pratiquement tous les couples, l’oxyde et le métal sont solides, l’oxydation du métal s’accompagne toujours de la consommation d’une mole de dioxygène. Par conséquent, pour tous les
couples métal / oxyde solides, ΔS° a pratiquement la même valeur : les pentes des droites sont donc identiques. D’autre part, la courbe relative au couple C/CO est la seule à présenter une pente négative. En effet, au cours de la réaction :
2C + O2 →2CO
La variation du nombre de moles gazeuses (tous les constituants sont gazeux) est égale à 2 - (1 + 2) = - 1. Ce nombre étant négatif, la réaction s’accompagne d’une diminution du désordre (le nombre de moles gazeuses diminue), donc ΔS° < 0, ou -
TΔS° > 0. Ainsi, la pente de la droite d’Ellingham est positive.
Les valeurs de ΔG° permettent de classer les oxydes selon leur pouvoir réducteur, qui dépend surtout de la température. On peut classer les réducteurs en trois groupes : les métaux très réactifs, comme le magnésium et l’aluminium, qui forment des
oxydes réfractaires (stables aux températures élevées), les métaux assez réactifs, comme le chrome et le fer, conduisant à des oxydes que l’on réduit facilement, et les métaux peu réactifs, tels que le cuivre et l’argent (dont la courbe est au-dessus
de celle du cuivre), qui s’oxydent très difficilement.
3.2
Prévision des réactions
Considérons les deux couples métal / oxyde associés aux réactions suivantes :

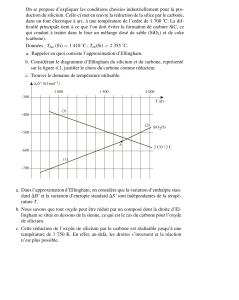
D’après le diagramme d’Ellingham, on a, à toute température, ΔG°1(T) << ΔG°2(T) (la courbe d’Ellingham du couple Al/Al2O3 est nettement en dessous de celle de Cr/Cr2O3). Considérons la réaction suivante, dont le bilan correspond à (1) - (2), et qui
est la réduction de l’oxyde de chrome par l’aluminium métallique :
La variation de l’enthalpie libre standard de cette réaction est : ΔG° = ΔG°1 - ΔG°2. Comme ΔG°1(T) << ΔG°2(T), alors ΔG° << 0. Ainsi, la réaction ci-dessus est totale de la gauche vers la droite, donc le métal aluminium réduit totalement l’oxyde de
chrome, quelle que soit la température. La comparaison des diagrammes d’Ellingham permet de prévoir le sens d’une réaction entre deux couples en présence : dans un domaine de températures ou à une température fixée, un métal peut réduire un
oxyde dont la courbe d’Ellingham est au-dessus de celle du métal.
4
APPLICATIONS INDUSTRIELLES
Les minerais à partir desquels on prépare les métaux purs sont toujours des oxydes métalliques. Il faut donc les réduire, ce qui s’effectue par deux voies distinctes dans l’industrie : la métallurgie électrochimique et la métallurgie thermique. Dans le
premier cas, on réalise la réduction par électrolyse (voir électrochimie), technique généralement délicate et coûteuse ; dans le second procédé, la réduction se fait à une température dépendant du réducteur chimique employé. En comparant la
position du diagramme d’Ellingham du couple métal / oxyde avec ceux des différents réducteurs envisagés, on peut choisir le composé chimique le plus approprié.
Les réducteurs industriels souvent employés sont le dihydrogène gazeux (H2) et le monoxyde de carbone gazeux (CO), respectivement associés à l’eau (H2O) et au dioxyde de carbone (CO2). Le coke (carbone correspondant au couple C/CO) est un
réducteur universel car la pente de sa droite d’Ellingham est négative. La courbe coupe donc toutes les autres. Ainsi, pour tout couple métal / oxyde, il existe forcément un domaine de températures dans lequel la droite du couple C/CO est en dessous
de celle du couple considéré. À ces températures, le coke peut alors réduire l’oxyde.
Industriellement, la réduction des minerais doit être la plus complète (aspect thermodynamique), la plus rapide (aspect cinétique) et la moins chère possible. Le diagramme d’Ellingham ne fait intervenir que les considérations thermodynamiques.
D’autre part, la pureté du métal préparé dépend entre autres de celle du réducteur ; il est donc nécessaire que ce dernier soit le plus pur possible.
Voir aussi métallurgie ; métaux ; sidérurgie.
Microsoft ® Encarta ® 2009. © 1993-2008 Microsoft Corporation. Tous droits réservés.
1
/
2
100%