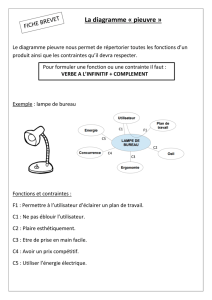
Juin 2013 - L3 Chimie Dijon

Licence de Chimie L3 27 juin 2013
7LCHI512CE
Epreuve de Chimie Inorganique
Réactivité des solides inorganiques
Durée : 2h
Toute réponse doit être clairement justifiée (calculs, réactions chimiques…) et il sera tenu compte
de la présentation. Les calculettes sont autorisées.
I – Diagramme d’état d’oxydation du plomb
On donne à 25°C et à pH = 0 les potentiels standard E° des couples oxydant/réducteur suivants :
Ox / Red
Pb2+ / Pb (s)
Pb3O4 (s) / Pb2+
PbO2 (s) / Pb3O4 (s)
H3O+ / H2 (g)
Cl2 (g) / Cl-
E° / V
-0,13
2,09
1,13
0
1,358
1 - Tracer le DEO du plomb sur le graphe 1 donné en annexe.
2 - Quel est le degré d’oxydation du plomb le plus stable ?
3 - Que dire de l’oxyde Pb3O4 ? Justifier et écrire les équations bilans.
4 – Discuter l'action de l’acide chlorhydrique sur le plomb.
II – Diagramme d’Ellingham
1 – Sur le graphe 2 donné en annexe, tracer le diagramme d’Ellingham du nickel. Indiquer les
domaines de stabilité du métal et de l’oxyde.
2 – On désire réduire l’oxyde de nickel NiO par le carbone sans obtenir de dégagement de
monoxyde de carbone. Déterminer à l’aide du diagramme le domaine de température dans lequel on
doit se placer.
3 – On désire obtenir du nickel métallique au degré d’oxydation 0 à 400 K. Estimer graphiquement
à l’aide du diagramme la pression maximale de dioxygène qu’il peut régner dans l’enceinte
réactionnelle sans qu’il y ait formation de NiO. Est-ce facilement réalisable ? Que pourrait-on
faire ?
On donne : 2Ni(s) + O2(g) 2NiO(s) rG° = -482 + 0,188T en kJ.mol-1
III – Diagramme de Pourbaix
On donne en annexe le diagramme de Pourbaix de l’argent.
1 – Quelles sont les différentes entités chimiques en solution aqueuse figurant dans le diagramme ?
Déterminer le degré d’oxydation de l’argent dans ces entités.
2 – Quelles sont les particularités des lignes 1’ et 2’ ? Ecrire les équilibres chimiques impliquant les
espèces majoritaires dans la solution aqueuse lorsqu’on se trouve au voisinage de ces deux lignes.
Quelles grandeurs thermodynamiques peut-on tirer de ces deux lignes ? Les évaluer.
3 – Est-ce que l’oxyde Ag2O est thermodynamiquement passivant ? Distinguer alors clairement sur
le diagramme les domaines de corrosion, d’immunité et de passivation de l’argent.
4 – Dans quelles conditions l’argent métallique peut-il être utilisé sans risque en présence d’eau ?
Peut-on trouver l’argent à l’état natif (degré d’oxydation zéro) dans la nature ?
5 – Expliquer ce qu’est la protection cathodique.
1
/
1
100%