Obtention d`un métal par voie sèche

-1-
Matériaux 1 :
Obtention d’un métal par voie sèche
Certains métaux existent dans la nature à l’état de corps simples non oxydés (c’est ce qu’on appelle « l’état natif » du métal).
C’est le cas du platine, du palladium, de l’or… mais il s’agit d’exceptions. Ces rares métaux sont appelés métaux nobles.
La plupart des métaux existent dans la nature sous formes de corps composés oxydés, à l’état de minerai. Ce sont des formes
faisant intervenir le métal, ainsi que des atomes d’oxygène, de soufre, de phosphore, etc…
Pour élaborer un métal solide pur à partir des minerais, on utilise des méthodes de métallurgie. Il s’agit d’opérer des réductions
consistant à transformer le métal oxydé en métal natif. Plusieurs méthodes sont envisageables :
Pyrométallurgie : il s’agit d’une réduction par chauffage, en présence d’un réducteur solide ou gazeux. On parle
également de réduction par voie sèche.
Hydrométallurgie : il s’agit d’une réduction électrochimique, en solution aqueuse.
Nous allons nous intéresser ici à la pyrométallurgie, d’un point de vue strictement thermodynamique.
Dans ce chapitre, il n’est question que d’oxydo-réduction par voie sèche. Il ne faut donc pas faire
intervenir des ions (en particulier H+) ou des électrons dans les équations des processus.
Outil : Nombre d’oxydation d’un élément (NOEL) au sein d’un constituant chimique
Si le NO d’un élément n’est pas le même au sien des 2 constituants d’un couple, alors il s’agit d’un couple redox.
NO d’un élément dans un édifice monoatomique :
NO d’un élément dans un édifice polyatomique :
La détermination du NO d’un élément dans un édifice polyatomique passe par l’écriture de sa formule de
Lewis. Pour chaque liaison, on donne arbitrairement le doublet d’électrons à l’atome le plus
électronégatif. Dans le cas d’une liaison reliant deux atomes identiques, chacun reçoit un électron.
Le NO correspond à la charge formelle apparaissant sur l’atome après l’opération de partage des
électrons :
NO(X) = (nbe e- de valence à l’état fondamental) – (nbe e- de valence à l’état fictif obtenu) .
Pour de nombreux édifices rencontrés en chimie inorganique (oxydes, hydroxydes, …), on accède rapidement
au NO moyen d’un élément dans la structure grâce au fait que la somme des NO des éléments d’un édifice est
égale à sa charge globale. On pose alors, NO(O) = - II et NO(H) = + I. Mais ce mode de calcul ne fonctionne que
si tous les atomes d’oxygène sont liés à des atomes moins électronégatifs que O, et que tous les atomes
d’hydrogène sont liés à des atomes plus électronégatifs que H (c’est souvent le cas).

-2-
1. Construction du diagramme d’Ellingham
1.1. Convention
On s’intéresse ici aux réactions d’oxydation par voie sèche, l’agent oxydant étant le dioxygène gazeux. Il peut oxyder :
a) un métal de l’état natif M vers un de ses oxydes MxOy
b) OU, un oxyde MxOy vers un « oxyde supérieur » Mx’Oy’
Ces réactions étant des oxydations, le nombre d’oxydation du métal augmente dans les deux cas.
Convention :
Les équations des réactions utilisées pour le tracé d’un diagramme d’Ellingham sont écrites dans le sens de l’obtention
d’oxydes avec un nombre stœchiométrique pour le dioxygène égal à – 1.
Expl : Couple GeO(s) / Ge(s) :
Couple Fe2O3(s) / FeO(s) :
1.2. Diagramme d’Ellingham
On appelle diagramme d’Ellingham, un diagramme tel que :
- Abscisse : la température T
- Ordonnée : la grandeur y = RT ln
Sur lequel on représente un ensemble de droites, nommées droites d’Ellingham, qui représentent, pour un couple
d’oxydo-réduction par voie sèche, les variations de l’enthalpie libre standard de réaction rG° de la réaction
d’obtention de l’oxyde en fonction de T.
Expl : Couple MxOy / M :
M + O2(g) =
MxOy
y = RT ln
(J.mol−1) T (K)
A

-3-
Un point quelconque A du diagramme a pour coordonnées :
Un point appartenant à une droite d’Ellingham a pour coordonnées :
Remarque : Très souvent, l’ordonnée indiquée sur le diagramme est ΔrG°(T). Cela signifie simplement que son « auteur » a voulu
rappeler la signification des droites du diagramme, et non celle des points figurant entre les droites.
1.3. Droites d’Ellingham et approximation d’Ellingham
Pour un couple d’oxydoréduction par voie sèche donné, la courbe tracée représente les variations de l’enthalpie libre standard
de la réaction d’obtention de l’oxyde (υO2 = -1) en fonction de la température : ΔrG°(T) = f(T).
rG°(T) = rH°(T) – T rS°(T)l
Avec : Couple MxOy / M :
M + O2(g) =
MxOy
ΔrH° (T) =
ΔfH° (M , T) ΔfH°(O2(g) , T) +
ΔfH° (MxOy , T) (Loi de Hess)
ΔrS° (T) =
Sm° (M , T) Sm° (O2(g) , T) +
Sm° (MxOy , T) (Définition de ΔrS°)
rH°(T) et rS°(T) dépendent de la température T, la représentation graphique de ΔrG° = f(T) devrait donc être courbe.
En revanche, on peut obtenir un diagramme simplifié en se plaçant dans l’approximation d’Ellingham :
Énoncé de l’approximation d’Ellingham :
Sur un intervalle de température suffisamment réduit, en l’absence de changement d’état de l’un des
constituants intervenant dans l’équation de la réaction, ΔrCp° est supposé nul.
Par conséquent, ΔrH° et ΔrS° sont indépendants de T.
Conséquence :

-4-
Un diagramme d’Ellingham est donc un ensemble de segments de droite, présentant des ruptures de pente quand l’un des
constituants du couple rédox par voie sèche change d’état physique.
1.4. Tracé du diagramme d’Ellingham du couple ZnO/Zn
Données : Exercice 7 du TD
à 298 K
Zn(s)
ZnO(s)
O2(g)
Si° (J.K-1.mol-1)
42,0
44,0
205
ΔfHi° (kJ.mol-1)
0
- 348
0
Tfus = 693 K et ΔfusH° = 7,00 kJ.mol-1
Tvap = 1180 K et ΔvapH° = 115 kJ.mol-1
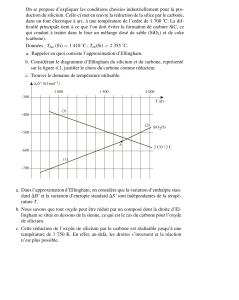
1. Equation de l’oxydation par voie sèche associée au couple ZnO/Zn :
2. Entre 300 K et 693 K, le zinc est solide.

-5-
3. Entre 693 K et 1180 K, le zinc est liquide.
Nouvelle équation d’obtention de l’oxyde :
Prévision qualitative de l’évolution de la pente :
Obtention de la nouvelle équation de droite :
Les données ne fournissent pas d’information concernant le zinc à l’état liquide (ce n’est pas toujours le cas). Il faut
donc calculer les nouvelles enthalpie et entropie standard de réaction à partir de celles obtenues pour le zinc solide.
L’utilisation d’un cycle permet d’accéder rapidement au résultat :
4. Au-delà de 1180 K, le zinc est gazeux.
Nouvelle équation d’obtention de l’oxyde :
Obtention de la nouvelle équation de droite :
Ici encore, il faut déterminer les nouvelles enthalpie et entropie standard de réaction à partir de celles obtenues pour
le zinc liquide, grâce à un cycle :
On obtient : ΔrG° (T) = - 940 + 0,416 T (e kJ.mol-1, pour T > 1180 K)
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
1
/
17
100%