Exercices sur les diagrammes d'Ellingham : Thermodynamique chimique

PSI Lycée CONDORCET BELFORT
DIAGRAMMES D’ELLINGHAM - EXERCICES
1. Fusion de l'argent récupéré ( CCP MP 01 )
L'argent récupéré dans les films photographiques est sous forme divisée. Pour obtenir un lingot, on envisage une
fusion. Il s'agit de savoir s'il faut prendre des précautions lors de la montée en température (pas de contact avec de
l'oxygène ou de l’air).
a) Ecrire pour une mole de O2 les réactions d'oxydation de l'argent : Ag2O/Ag , Ag2O2/Ag2O , Ag2O3/ Ag2O2.
b) Etablir les expressions numériques de l'enthalpie libre des réactions en fonction de la température selon les
approximations d'Ellingham.
c) Tracer le diagramme d'Ellingham dans le domaine de température de 0 à 600 K (graduations 1 cm pour 50 K et 1
cm pour 20 kJ). Préciser les domaines d'existence de chaque espèce. Commenter.
d) Calculer la température d'équilibre pour Ag2O/Ag dans de l'oxygène pur à P = 1 bar.
e) Calculer la température d'équilibre pour Ag2O/Ag dans de l'air à P = 1 bar (1/5 oxygène, 4/5 azote).
f) Conclure.
Données à T = 298 K ; R = 8,32 J. K-1.mol-1
fH°(kJ.mol-1)
S° (J.K-1.mol-1)
Ag(s)
42,55
Ag2O (s)
-31,1
121,3
Ag2 O2 (s)
-24,3
117,0
Ag2O3 (s)
33,9
100
O2 (g)
205,2
2. Métallurgie du zinc par voie sèche :
Cette métallurgie est basée sur la réaction suivante :
ZnO + CO CO2 + Zn
Le zinc peut être obtenu solide, liquide ou vapeur selon la température.
a) Tracer le diagramme d’Ellingham pour Zn et CO entre 300 et 2000 K.
b) A partir de quelle température la réduction de ZnO par CO est-elle possible dans les conditions standard
? Dans quel état physique se trouve le zinc ?
c) Quelle est la variance du système ? Conséquence ?
d) Dans l’industrie, la réduction de ZnO se fait à 1300 K sous une pression totale de 1 bar. calculer
l’enthalpie libre standard de réaction à cette température. Quel est le rapport minimal des pressions
partielles PCO/PCO2 nécessaire pour déplacer la réaction dans le sens (1) si l’on désire une pression de
vapeur de zinc égale à PZn = 0,5 bar ?
Données (en kJ.mol-1 ) : 2Zn(s) + O2(g) 2ZnO(s) rG1° = -696 +0,201.T
2Zn(l) + O2(g) 2ZnO(s) rG2° = -709 +0,220.T
2Zn(g) + O2(g) 2ZnO(s) rG3° = -939 +0,415.T
2CO(g) + O2(g) 2 CO2 (g) rG4° = -566 +0,174.T
Tfus(Zn) = 693 K ; Tvap( Zn ) = 1180 K.
3. Oxydation du carbone :
On donne, à T = 298 K ( cf ci-contre ) :
a) L'oxydation du carbone donne deux oxydes gazeux
CO et CO2 ; écrire les réactions d'oxydation de C en
CO, puis de CO en CO2 ( rapportées à une mole de
O2 ) et calculer leurs enthalpies libres standard dans
l’approximation d’Ellingham.
b) Construire le diagramme d’Ellingham. Montrer que,
dans un certain domaine de température, le monoxyde de carbone peut se dismuter. Ecrire la réaction de
dismutation et calculer son enthalpie libre standard. En déduire le domaine de prédominance de CO, puis
de C et CO2.
c) Déduire du diagramme l'oxyde que l'on obtient par oxydation du carbone, suivant la température T.
H° ( kJ.mol-1)
S° (J.K-1.mol-1 )
Cgraphite
0
5,5
O2g
0
205,0
COg
- 110,5
197,6
CO2g
-393,5
213,7

4. L'oxyde de thallium ( Mines-Ponts MP 04 )
L'oxyde de thallium est utilisé dans la fabrication de verre à indice de réfraction élevé (flint).
1- Vérifier que l'entropie standard de fusion du thallium à 304°C est de l'ordre de 7 J.K-l.mol–1, valeur que
l'on utilisera par la suite.
2-Ecrire l'équation-bilan de la réaction (1) de formation de l'oxyde de thallium T12O solide à partir du
thallium (solide ou liquide) et du dioxygène gazeux. Le coefficient stoechiométrique du dioxygène sera pris
égal à 1.
3- Rappeler en quoi consiste l'approximation d'Ellingham.
4- Donner les expressions de l'enthalpie libre standard
0
r1
G
associée à la réaction (1) entre 300K et 1500K
en se plaçant dans l'approximation d'Ellingham.
5- Calculer à 300K, puis à 1500K, la valeur de la pression de dioxygène à l'équilibre. Comment appelle-t-on
cette pression ? En déduire la forme stable du thallium à 300K et à 1500K sous une pression de dioxygène
de 21300 Pa.
6- Tracer le graphe décrivant l'évolution de
0
r1
G
en fonction de T sur l'intervalle de température 300-
1500K. Superposer la droite correspondant à l'oxydation (2) du cuivre Cu, solide, en oxyde CuO, solide,
entre 300K et 1350K, toujours pour une mole de dioxygène gazeux:
0
r2
G
= – 312 + 0,192 T en kJ.mol–1
7- Dans quel domaine de température le cuivre métal peut-il réduire l'oxyde de thalium T12O ? Ecrire
l'équation-bilan de la réaction correspondante.
Données à 300 K:
fH° ( kJ.mol-1)
S° (J.K-1.mol-1 )
Tl2Os
-180
125
Tls
0
65
O2g
0
206
fusHo( Tl ) = 4 kJ.mol-1 à 304°C ; Tf(Tl) = 304°C sous P° = 1 bar.
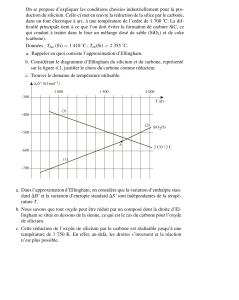
5. Réduction de l’oxyde de cuivre (CCP TSI 05) :
a) En raisonnant sur leur pente, attribuer aux segments de droites
de la figure les couples suivants : CO/C, CO2/C et CO2/CO.
b) Etablir le diagramme d’Ellingham du carbone et de ses oxydes
en ne gardant que les segments de droite ayant physiquement un
sens. Quelle est l’espèce majoritaire dans chaque domaine du plan
ainsi délimité ?
c) Tracer sur la figure le diagramme d’Ellingham du couple
CuO/Cu ( rapporté à une mol de O2).
d) Montrer qu’à température ambiante sous un bar, le cuivre
s’oxyde à l’air.
e) Parfois, en chauffant, à partir d’une certaine température, la
couche d’oxyde disparaît. Expliquer pourquoi ; est-ce le cas du
cuivre dans l’intervalle de température considéré [300, 1200 K] ?
Le cuivre semble être le premier métal qui ait été produit à partir de
son minerai.
f) Déterminer en fonction de la température, les produits obtenus
lorsque l’on chauffe de l’oxyde de cuivre CuO en présence de carbone.
g) Que se passe-t-il si l’on refroidit jusqu’à 500 K les produits obtenus dans les conditions précédentes ?
Données à 25 °C :
fH° ( kJ.mol-1)
S° (J.K-1.mol-1 )
Tfusion (°C)
CuOs
-157,3
42,6
1326
Cus
0
33.2
1083
O2
0
205,0
Réponse : :rGo( T ) = -314,6 + 0,186 T en kJ.mol-1.
-600
-500
-400
-300
-200
-100
0300 500 700 900 1100
1
/
2
100%