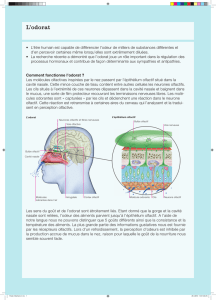
Les récepteurs olfactifs et le codage neuronal de l - iPubli

SYNTHÈSE
dré Hoey
Gles Sicard
E

I,
K,
Une stratégie originale
pour la réception
10,

6
�
o
Q
La représentation
distribuée de /'odeur


Le� anosmies. sélectives
m1eux compr1ses
Les glomérules olfactifs
et la chimiotopie
 6
6
 7
7
 8
8
1
/
8
100%