Suivi cinétique d`une réaction

Activités expérimentales TS 2012 Chimie
AE_cinetique_CCM page sur 2 ©GIGOT/VINCENT
SUIVI CINETIQUE D'UNE REACTION PAR C.C.M.
Mettre en œuvre une démarche expérimentale pour suivre dans le temps une synthèse organique par
CCM et en estimer la durée.
I. Objectif et documents :
(App) Originaire de la Perse et du Cachemire, la fleur de Jasmin est appelée "reine de la nuit" car son
odeur embaume dès que le soleil se couche. Le Jasmin est aujourd’hui principalement cultivé en Egypte,
où les cueilleuses ramassent ses fleurs délicates à la main au lever du soleil afin de conserver le plus
fidèlement son parfum intense. Ceci explique que l’huile essentielle de Jasmin est très chère, environ 30
euros les 5 mL. Il est heureusement possible de remplacer le produit naturel par un produit de synthèse,
l’éthanoate de benzyle.
On souhaite alors suivre la cinétique de la réaction de synthèse de l'éthanoate de benzyle.
La réaction est suffisamment lente pour suivre son évolution grâce à des prélèvements réguliers et
analyser ces prélèvements par chromatographie sur couche mince (CCM) sous UV.
Il est à noter que seul le noyau benzénique (réactif 2 et produit 1) est sensible aux UV dans cette
CCM d’où non visibilité des autres molécules (réactif 1 et produit 2) où ce noyau est absent.
Solutions disponibles sous hotte :
- solution R (=réactif 2) dans tube à hémolyse obtenue en dissolvant une goutte d'alcool benzylique dans
2 mL de cyclohexane.
- solution P (=produit 1) dans tube à hémolyse obtenue en dissolvant une goutte d'éthanoate de benzyle
dans 2 mL de cyclohexane.
- solution d’anhydride éthanoïque et solution alcool benzylique disponibles en flacons avec distributeur
automatique
Réactif 1
Réactif 2
Produit 1
anhydride éthanoïque :
alcool benzylique :
éthanoate de benzyle :
µ1 = 1,08 g.mL1
µ2 = 1,05 g.mL1
µ3 = 1,10 g.mL1
Le produit 2 de la réaction est à identifier dans la question Q1.
(Rea) Précautions : identification des risques : voir fin du livre rabat IV
Données : masses molaires atomiques M(H) = 1,0 g.mol1 / M(C) = 12,0 g.mol1 / M(O) = 16,0 g.mol1
II. Protocole :
(Ana) Proposer un protocole permettant d’assurer le suivi cinétique de la synthèse de l’éthanoate de
benzyle et d’en estimer la durée. Il est conseillé de lire l’intégralité de l’énoncé pour trouver des éléments
de réponses…
(Rea) Mettre en œuvre ce protocole avec le complément d’informations données par votre professeur.
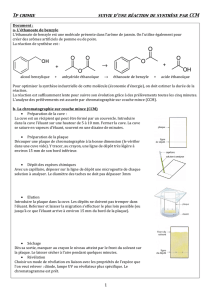
III. (Rea) Manipulation : synthèse et CCM
Introduire dans un ballon bicol sec quelques grains de pierre ponce puis mesurés au distributeur
automatique
V1 = 15 mL d'anhydride éthanoïque et
V2 = 12 mL d'alcool benzylique.

Activités expérimentales TS 2012 Chimie
AE_cinetique_CCM page sur 2 ©GIGOT/VINCENT
Placer le ballon sous le réfrigérant à boules, l'attacher à l’aide du clip en plastique.
Remonter le chauffe-ballon déjà chaud (attention !) et placer la hotte aspirante au-dessus du réfrigérant.
Déclencher alors le chronomètre ! On supposera la réaction suffisamment lente pour la chronométrer
qu’à partir du moment où elle est chauffée.
Faire circuler doucement la circulation d'eau (risque que le tuyau se décroche si trop
de pression !) puis chauffer le mélange à ébullition douce jusqu’au dernier
prélèvement décidé.
Déposer sur les deux plaques au niveau des marques numérotées les prélèvements
aux dates correspondantes dans le tableau établi avec votre professeur. Ne pas oublier
les dépôts R et P ! Les prélèvements sont réalisés avec un capillaire (neuf à chaque
fois) en enlevant provisoirement le temps du prélèvement, le bouchon du ballon bicol
(voir flèche sur le dessin ci-contre).
Une fois les deux CCM effectuées et séchées, procéder à l'élution en plaçant les
plaques dans les deux cuves.
Couper le chauffage et baisser le chauffe-ballon mais ne pas couper l’eau (ballon chaud = vapeurs).
Stopper la progression de l’éluant à un moment décidé avec votre professeur : sécher les plaques au
sèche-cheveux sous hotte aspirante.
Révéler le chromatogramme aux ultraviolets.
Entourer les tâches observées (= noyau benzénique présent) au crayon de papier.
Une fois le ballon refroidi, le décrocher et verser le contenu dans le flacon poubelle étiqueté « Résidus des
flacons » placé sous la hotte. Couper l’eau et la hotte.
Rincer le ballon avec un peu d’acétone et récupérer l’acétone dans le flacon poubelle adéquat.
Placer le flacon dans l’étuve à 30°C afin de le sécher.
IV. Exploitation : à la maison si non fini en séance
Lors de la synthèse, la molécule d'anhydride éthanoïque se « coupe en deux ».
Une partie s'associe avec l'alcool benzylique (dépôt R)
OH
pour former
l'ester éthanoate de benzyle (dépôt P)
OO
.
Q1: (Ana) Ecrire l'équation de la réaction de synthèse avec les formules semi-développées et identifier
le deuxième produit de la réaction.
Q2: (Ana) Identifier les groupes caractéristiques et les entourer sur votre énoncé.
Q3: (Rea) Calculer les quantités des réactifs introduits dans le ballon. Quel réactif est limitant ?
Q4: (Ana) A partir des chromatogrammes de l'ensemble de la classe, reproduits au tableau, répondre à
la problématique du II..
Q5: (Val) Critiquer cette méthode de la C.C.M..
1
/
2
100%