Alcools, aldéhydes et cétones

Alcools, aldéhydes et cétones
Notions et contenus
Compétences attendues
Liaison covalente.
Formules de Lewis ; géométrie des molécules.
Rôle des doublets non liants.
Alcools, aldéhydes, cétones : nomenclature, oxydations.
Acides carboxyliques : nomenclature, caractère acide, solubilité et pH.
Décrire à l’aide des règles du « duet » et de l’octet les liaisons que peut
établir un atome (C, N, O, H) avec les atomes voisins.
Interpréter la représentation de Lewis de quelques molécules simples.
Mettre en relation la formule de Lewis et la géométrie de quelques
molécules simples.
Nommer des alcools, aldéhydes, cétones et acides carboxyliques.
Écrire l’équation de la réaction d’oxydation d’un alcool et d’un
aldéhyde.
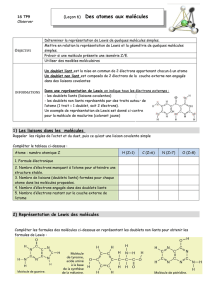
I) Les molécules
1) Structure électronique, électrons de valence
Un élément est déterminé par la valeur du numéro atomique qui correspond au nombre de protons dans le
noyau de l'élément. C'est aussi le nombre d'électrons présents dans le nuage électronique de l'atome.
Ces électrons se répartissent dans différentes couches électroniques nommée K, L, M, N etc…
Règle du duet et de l'octet: "Les atomes ont tendance à gagner ou perdre des électrons de manière à acquérir la
structure électronique du gaz noble le plus proche".
Ceci conduit donc les atomes à compléter leurs couches électroniques à 2 e- pour la couche K (règle du duet)
et 8 e- pour les couches L et M (règle de l'octet).
En chimie organique, on rencontre principalement les éléments suivants:
H: Z = 1 structure électronique: (K)1 H doit gagner 1 e- (monovalent)
C: Z = 6 structure électronique: (K)2(L)4 C doit gagner 4 e- (tétravalent)
N: Z = 7 structure électronique: (K)2(L)5 N doit gagner 3 e- (trivalent)
O: Z =8 structure électronique: (K)2(L)6 O doit gagner 2 e- (divalent)
2) Liaison covalente, formule de Lewis
Lors de la formation de molécules, les atomes mettent en commun des électrons de valence pour former des
doublets liant les deux atomes. Les autres électrons de la couche externe forment des doublets non liants.
Les doublets liants appartiennent indifféremment aux deux atomes. Ces formations de liaisons covalentes sont
font dans le respect de la règle du duet et/ou de l'octet.
La représentation des atomes composant la molécule ainsi que de tous les doublets s'appelle la formule de
Lewis.
Donner la formule de Lewis de:
L'eau (H et O)
Le méthane (C et H)
L'ammoniac (N et H)
Le dioxyde de carbone (C et O)
L'éthanol (C, H et O)
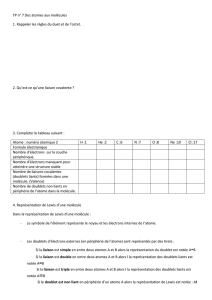
3) Géométrie des molécules
Les doublets, qu'ils soient liants ou non liants sont formés d'électrons, porteurs d'une charge négative. Des
corps possédant une même charge se repoussent.
La molécule d'eau devrait donc présenter une structure linéaire pour que les doublets liants soient les plus
éloignés possibles.
Or, la molécule d'eau est coudée.
Comment expliquer ceci?
C'est le canadien Ronald Gillespie qui développa la VSEPR dans la deuxième moitié du XX° siècle
VSEPR: Valence Shell Electron Pair Repulsion
Prévoir alors la géométrie des molécules de méthane, d'ammoniac et de dioxyde de carbone.

II) Alcools, aldéhydes, cétones
1) Les alcools
Ils sont caractérisés par le groupe hydroxyle porté par un carbone n'étant lié à aucun autre groupe
caractéristique et n'engendrant pas de liaison multiple avec un autre carbone.
Donner la représentation de Lewis du méthanol.
2) Aldéhydes et cétones
Ces composés organiques sont caractérisés par la présence du groupe caractéristique
carbonyle C=O.
Si ce groupe caractéristique se trouve en bout de chaîne, la fonction correspondante
est la fonction aldéhyde.
Si le groupe carbonyle est en milieu de chaîne, la fonction correspondante est la fonction cétone.
3) Nomenclature des aldéhydes et cétones
Le nom de l'aldéhyde est obtenu en substituant le e final du nom de l'alcane par la terminaison "al".
Le nom de la cétone est obtenu en substituant le e final du nom de l'alcane par la terminaison "one".
Donner le nom des molécules suivantes:
Exercice inverse: donner la formule topologique des molécules suivantes:
- 2-méthylbutanal
- 3-méthylpentan-2-one
III) Les acides carboxyliques
1) Nomenclature
Les acides carboxyliques sont des molécules organiques portant le groupe fonctionnel carboxyle:
De par la nature de ce groupe, il ne peut se situer qu'en bout de chaîne.
Le nom de l'acide sera obtenu à partir du nom de l'alcane (sans oublier le C du groupe fonctionnel) dont le "e"
sera remplacé par "oïque", le tout étant précédé du terme "acide".
La numérotation de la chaîne carbonée démarre impérativement sur le C du groupe carboxyle.
Formule générale d'un acide carboxylique: R – COOH.
Exemples: Nommer ou représenter les acides suivants:
Acide éthanoïque (vinaigre); Acide 2,3-diméthylbutanoïque
2) Solubilité et acidité
Les acides carboxyliques de petite chaîne carbonée (moins de 4 atomes de carbone) sont très solubles dans
l'eau.
Cette solubilité décroit au fur et à mesure que la chaîne carbonée s'allonge.
Les acides gras sont des acides carboxyliques à longue chaîne carbonée (de 4 à 36).
Quand ils sont en solution, les acides carboxyliques ont tendance à céder leur proton à une molécule d'eau
selon la réaction:
R – COOH(aq) + H2O(l) R – COO-(aq) + H3O+(aq)
C'est la présence d'ions oxonium (H3O+) en solution qui lui donne un caractère acide. En revanche, les
solutions basiques contiennent beaucoup d'ions hydroxyde (HO-).
Le pH (potentiel Hydrogène d'une solution traduit son acidité. Plus le pH est faible, plus la concentration en
ions oxonium est grande.

A pH élevé, la forme acide R – COOH est remplacée par la base conjuguée R – COO- , laquelle est beaucoup
plus soluble (voir cours de seconde sur l'aspirine).
IV) Oxydation des alcools et des aldéhydes
1) Oxydation ménagée d'un alcool
Celle-ci va donner naissance à un aldéhyde ou une cétone selon la classe de l'alcool:
Une oxydation ménagée est obtenue en laissant agir le dioxygène de l'air ou avec un oxydant tel que l'ion
permanganate.
Application: Ecrire l'équation bilan de l'oxydation ménagée du 2-méthylbutan-1-ol et du 2-méthylbutan-2-ol.
Nommer les produits obtenus.
2) Oxydation ménagée d'un aldéhyde
Elle conduit à la formation d'un acide carboxylique:
Application: oxydation du benzaldéhyde par le dioxygène de l'air:
soit
1
/
3
100%