RESUME DES CARACTERISTIQUES DU PRODUIT 1

resumé des caracteristiques du produit
RESUME DES CARACTERISTIQUES DU PRODUIT
1 DENOMINATION DU MEDICAMENT
Antébor, solution pour usage cutané.
2 COMPOSITION QUALITATIVE ET QUANTITATIVE
Antébor contient de la sulfacétamide sodique 10%.
Pour la liste complète des excipients, voir rubrique 6.1
3 FORME PHARMACEUTIQUE
Solution pour usage cutané.
4 DONNEES CLINIQUES
4.1 Indications thérapeutiques
Traitement d’appoint des affections dermatologiques sensibles aux sulfamides.
Proposé en traitement d’appoint dans l’acné à composante inflammatoire, notamment
l’acné polymorphe à composante inflammatoire.
4.2 Posologie et mode d’administration
Posologie
1 à 2 applications par jour.
Population pédiatrique
Antébor ne doit pas être utilisé chez les prématurés ou les nouveau-nés.
Mode d’administration
Traitement de l’acné:
Matin et soir, après la toilette, lotionner abondamment et à plusieurs reprises en laissant
sécher sans essuyer.
4.3 Contre-indications
- Hypersensibilité au principe actif ou à l’un des excipients mentionnés à la rubrique
6.1.
- Dermatoses allergiques, eczématisées, prurigineuses;
- Des personnes avec une anamnèse de contact ou une sensibilisation générale ou
locale connue aux sulfamides.
- Étant donné le risque de résorption systémique et le rôle favorisant possible dans
l’apparition d’un ictère nucléaire lié à l’immaturité des systèmes enzymatiques du
nouveau-né, on ne peut pas utiliser l’Antébor chez:
- la femme en fin de grossesse ou pendant l’allaitement;
- le nouveau-né;
- le prématuré.
- Ne pas appliquer sur les blessures;
- en cas d’une insuffisance rénale;
4.4 Mises en garde spéciales et précautions particulières d’emploi
La résorption transcutanée du sulfacétamide peut donner lieu à des effets systémiques
dus aux sulfamides.
Les effets systémiques sont d’autant plus à redouter que l’Antébor est utilisé de façon
répétée sur une grande surface sous pansement occlusif, sur une peau lésée
1/4

resumé des caracteristiques du produit
(notamment brûlée), une muqueuse, une peau de prématuré ou de nourrisson (en raison
du rapport surface/poids et de l’effet d’occlusion des couches au niveau du siège.
Éviter l’application sur des plaies ouvertes, surtout des ulcères, les muqueuses et les
yeux.
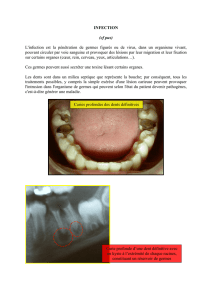
Une superinfection par des germes résistants est possible.
Il importe d’être prudent en cas d’une hypersensibilité connue envers d’autres sulfamides,
des diurétiques de l’anse, des diurétiques thiazidiques, le sulfone urée et les inhibiteurs
de l’anhydrase carbonique.
Une déficience du foie ou des reins peut augmenter la possibilité d’effets secondaires.
Incompatibilités: Lors de l’incorporation d’autres substances actives à la solution Antébor,
il faudra tenir compte du fait que le pH est légèrement basique et le titre alcoolique voisin
de 40%.
4.5 Interactions avec d’autres médicaments et autres formes d’interaction
Compte tenu des interférences possibles (antagonisme, inactivation,…), l’emploi
simultané ou successif d’autres topiques est à éviter, en particulier l’antagonisme entre
les sulfamides et les dérivés de l’acide para-amino-benzoïque et certains anesthésiques
locaux, la procaïne par exemple.
L’emploi simultané du Porfimer avec d’autres produits qui ont un effet de
photosensibilisation comme les sulfamides, peut augmenter la réaction de
photosensibilisation et peut mener à une détérioration grave de la peau. Il importe d’être
prudent quand le sulfamide est donné aux patients qui reçoivent le Porfimer pour une
thérapie photodynamique.
D’autres crèmes, lotions, médicaments utilisés sur la peau, un filtre solaire, des
cosmétiques contenant de l’alcool, sont à éviter.
4.6 Fertilité, grossesse et allaitement
En raison de la résorption systémique, l’utilisation de sulfamides et de l’Antébor en
particulier, est contre-indiquée:
- chez la femme enceinte en fin de grossesse et pendant l’allaitement;
- chez le nouveau-né;
- chez le prématuré (cfr. contre-indications).
4.7 Effets sur l’aptitude à conduire des véhicules et à utiliser des machines
Il n’y a pas de réactions connues concernant l’emploi de l’Antébor et la conduite de
machines. Il n’y a pas de problèmes à prévoir.
4.8 Effets indésirables
Au sein de chaque fréquence de groupe, les effets indésirables doivent être présentés
suivant un ordre décroissant de gravité: très fréquent (≥1/10); fréquent (≥1/100, <1/10);
peu fréquent (≥1/1 000, <1/100); rare (≥1/10 000, <1/1 000); très rare (<1/10 000),
fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Affections hématologiques et du système lymphatique
En cas de plaies ouvertes, le passage systémique du sulfacétamide expose au risque de
complications générales des sulfamides cet à dire: problèmes hématologiques, rénales,
urinaires, cutanées.
Affections de la peau et des tissus sous-cutanés
Eczéma de contact. Photosensibilisation. Moins de 2% des patients ont rapporté un
érythème, des démangeaisons et un sentiment fourmillé et irritant à la suite de l’usage
topique des sulfamides. Ces effets secondaires sont généralement de nature temporaire.
Des réactions hypersensibles comme un gonflement local, une rougeur, des
démangeaisons est remarquée chez les produits utilisés de manière locale. Ces
2/4

resumé des caracteristiques du produit
sensibilités peuvent apparaître chez des personnes sans prévalence d’hypersensibilité.
Les autres formes d’hypersensibilité sont l’exanthème et l’érythème multiforme.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est
importante. Elle permet une surveillance continue du rapport bénéfice/risque du
médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via
l’Agence fédérale des médicaments et des produits de santé, site internet :
‘www.afmps.be’.
4.9 Surdosage
Bien que peu probable et n’ayant jamais été décrits lors l’utilisation d’Antébor, les
symptômes d’intoxication aiguë devraient être ceux provoqués par une intoxication aux
sulfamides.
Chez le nourrisson, les sulfamides peuvent déplacer la bilirubine fixée aux protéines et
provoquer des ictères et des troubles neurologiques.
Traitement: lavage gastrique en cas d’absorption accidentelle, administration de liquide
afin d’augmenter la diurèse et l’élimination.
5 PROPRIETES PHARMACOLOGIQUES
5.1 Propriétés pharmacodynamiques
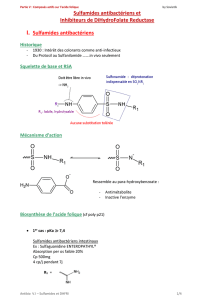
Classe pharmacothérapeutique: Sulfamides; Code ATC: D06BA10
L’Antébor contient un sulfamide soluble, bactériostatique vis-à-vis de nombreux germes
gram + et gram – et en particulier certains staphylococcies sensibles. Des souches
résistantes existent, surtout des staphylocoques. Ces germes cutanés peuvent être soit
des germes saprophytes responsables de la transformation des éléments métaboliques
en éléments inflammatoires dans l’acné, soit des germes rencontrés dans les infections
pyogènes de la peau.
La sulfacétamide sodique peut interférer avec la synthèse des acides nucléiques des
microorganismes sensibles et bloquer la conversion de l’acide para-amino-benzoïque en
acide déhydrofolique, forme réduite de l’acide folique.
5.2 Propriétés pharmacocinétiques
La pénétration de la sulfacétamide sodique dans la peau est très bonne. Des études en
vitro sur la peau de personnes décédés ont démontrés une absorption d’environ 4%. La
résorption systémique n’est pas négligeable, mais n’a pas été quantifiée.
La sulfacétamide résorbée est éliminée dans les urines, en grande partie sous forme
inchangée: Demi-vie plasmatique: 7 à 12,8 heures.
Le véhicule alcoolique possède une action anti-séborrhéique par ses propriétés
dégraissantes.
5.3 Données de sécurité précliniques
Pas de données a remettre.
6 DONNEES PHARMACEUTIQUES
6.1 Liste des excipients
Musc cétone – huile essentielle de bergamote – huiles essentielles de rose – huile
essentielle de citron – huile essentielle d’élémi –bromure de benzododecinium – éthanol
(96%) - eau purifiée.
6.2 Incompatibilités
Ne pas utiliser avec d’autres produits désinfectants ou des produits contenant de l’alcool.
6.3 Durée de conservation
2 ans.
3/4

resumé des caracteristiques du produit
6.4 Précautions particulières de conservation
A conserver à température ambiante (15°C-25°C).
6.5 Nature et contenu de l’emballage extérieur
Solution pour usage cutané. Bouteille de 200 ml de solution.
6.6 Précautions particulières d’élimination et manipulation
Pas d'exigences particulières.
7 TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
KELA Pharma nv/sa
Industriepark West 68
B-9100 Sint-Niklaas
8 NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
BE006212
9 DATE DE PREMIERE AUTORISATION/ DE RENOUVELLEMENT DE
L’AUTORISATION
Première autorisation: 1/12/1962
Renouvellement de l’autorisation: jj/mm/aaaa
10 DATE D’APPROBATION DU TEXTE
09/2014
4/4
1
/
4
100%