Synthèse de l`acide benzoïque

16/04/17 769778334 1/2
CHIMIE-Spécialité
SYNTHESE DE L'ACIDE BENZOÏQUE
Chap.8
I. Principe
L'acide benzoïque codé E 210 dans le code des additifs alimentaires est utilisé pour ses propriétés d'agent
de conservation, notamment dans les boissons de type soda.
La présente manipulation consiste à synthétiser l'acide benzoïque (acide carboxylique) par oxydation de
l'alcool benzylique, cette oxydation se fait en utilisant du permanganate de potassium.
La réaction d'oxydation s'effectuant en milieu basique les ions permanganate MnO4- sont réduits
à l'état de dioxyde de manganèse MnO2.
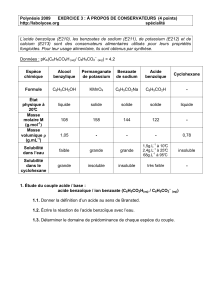
II. Données
Le benzoate de sodium C6H5COO - + Na+ est très soluble dans l'eau, et très peu soluble dans les solvants
organiques.
L'acide benzoïque C6H5COOH est peu soluble dans l'eau à 25°C (solubilité 2,4 g.L-1 à 25°C), mais
soluble en toutes proportions dans les solvants organiques .
L'alcool benzylique C6H5CH2OH et l'aldéhyde benzylique C6H5CHO sont peu solubles dans l'eau mais
leur solubilité dans l'éther est grande.
MnO2 est un solide brun. La formule du sulfite de sodium en solution est (2 Na+(aq) + S2O32- (aq)).
pKA (HCO3- /CO32-) = 10,3 ; pKA (C6H5COOH /C6H5CO2-) = 4,2
Couples oxydant/réducteur utiles : MnO4- /MnO2 ; MnO2/Mn2+; C6H5CO2-/ C6H5-CH2OH
Densité : Alcool benzylique : 1,05 ; Acide benzoïque : 1,27 ; Ether 0,71
Nom
Alcool benzylique
Acide benzoïque
Formule semi-
développée
CH2OH
Alcool benzylique
ou C6H5-CH2OH
CO2H
Acide benzoïque
ou C6H5-CO2H
III. Travail expérimental
A. Synthèse de l'acide benzoïque
Dans un ballon bicol de 250 mL, introduire : 2,00 g de carbonate de sodium, 5,00 g de permanganate
de potassium, 2,50 g d'alcool benzylique, 100 mL d'eau distillée.
Alimenter le réfrigérant en eau par le bas de la colonne verticale. Chauffer modérément de manière à
obtenir une ébullition douce (voir le schéma du livre page 116).
Le dioxyde de manganèse précipite : il se forme un précipité brun visible sur les parois du ballon.
Laisser l'ébullition douce se produire pendant environ 20 minutes.
Arrêter le chauffage et laisser le ballon refroidir, maintenir la circulation d'eau dans le réfrigérant.
B. Première filtration
Une filtration sous vide, appelée filtration sur Büchner, (voir le schéma du livre page 117) est plus
rapide, cependant la filtration avec entonnoir et papier filtre peut convenir.
Lorsque le ballon est assez froid, verser lentement son contenu dans l'entonnoir. Rincer le ballon à
l'eau distillée, et introduire les eaux de rinçage dans l'entonnoir.
C. Purification du produit obtenu
Si le filtrat a une teinte violette, y ajouter quelques mL de solution de sulfite de sodium. Introduire le
filtrat dans une ampoule à décanter. Y ajouter environ 40 mL d'éther, agiter, et dégazer plusieurs fois.
Laissez reposer, et récupérer la phase aqueuse dans un erlenmeyer.
D. Cristallisation
Placer l'erlenmeyer dans la glace pilée, et sous la hotte ajouter lentement 20 mL d'acide chlorhydrique
concentré ( porter gants et lunettes ). L'acide benzoïque formé précipite.
E. Deuxième filtration
Réaliser une nouvelle filtration en utilisant un nouveau filtre sur lequel on recueille les cristaux d'acide
benzoïque formé.

16/04/17 769778334 2/2
F. Rendement et identification
Peser un becher, y introduire les cristaux, les porter à une température d'environ 70°C pour les sécher.
Après déshydratation déterminer la masse des cristaux obtenus.
La température de fusion est un des critères de pureté d'un corps, on pourrait vérifier que cette
température de fusion est de 122 °C si on disposait d'un banc Kofler comme ci-dessous.
IV. Exploitation de l'expérience
Données : M(C) = 12,0 g.mol-1 ; M(H) = 1,0 g.mol-1 ; M(O) = 16,0 g.mol-1 ; M(K) = 39,1 g.mol-1 ;
M(Mn) = 54,9 g.mol-1
1) Pourquoi utilise-t-on un dispositif de chauffage à reflux ?
2) Pourquoi ne faut-il pas arrêter le réfrigérant tout de suite après la fin du chauffage ?
3) Donner une écriture topologique de l'alcool benzylique. Quelle est la classe de cet alcool ? Quels
produits peut-on obtenir par oxydation ménagée des alcools de cette classe ? Préciser les conditions
expérimentales.
4) Dans les conditions expérimentales, obtiendra-t-on l’acide benzoïque C6H5-CH2OH ou sa base
conjuguée C6H5CO2- ?
5) Écrire la réaction d'oxydoréduction entre l'alcool benzylique et l'ion permanganate en milieu basique.
Utiliser l'équation H+ (aq) + HO-(aq) = H2O pour écrire l'équation en milieu basique.
6) Calculer les quantités de matière d'alcool benzylique, et d'ions permanganate, et en déduire que ces
derniers constituent le réactif limitant.
7) Quel est l'intérêt de la première filtration ? Que contient le filtre ?
8) Dans l'étape de purification, comment savoir où se trouvent la phase aqueuse et la phase organique ?
9) Écrire les équations chimiques ayant lieu lors de l'ajout de l'acide chlorhydrique. Quel est l'intérêt de
cet ajout ?
10) Quel est l'intérêt de la glace dans la cristallisation ?
11) Quel est l'intérêt d'une recristallisation ?
12) Déterminer l'avancement maximal et l'avancement final de cette réaction. Calculer le rendement de
la synthèse.
1
/
2
100%