Activité expérimentale 1 (chapitre 14) : Synthèse de l*aspirine

Activité expérimentale 1 (chapitre 14) : Synthèse de l’aspirine
Page 1 sur 7
Activité expérimentale 1 (chapitre 14) : SYNTHESE DE L’ASPIRINE
Notions et contenus
Compétences exigibles
- Identification d’un catalyseur, d’un produit.
- Détermination des quantités des espèces
mises en jeu, du réactif limitant.
- Choix du montage.
- Calcul d’un rendement.
- Aspect lié à la sécurité.
- Coûts.
- Pratiquer une démarche expérimentale pour
synthétiser une molécule organique d’intérêt
biologique à partir d’un protocole.
- Identifier des réactifs et des produits à l’aide
de spectres et de tables fournies.
- Comparer les avantages et les inconvénients
de deux protocoles.
I) DOCUMENTS
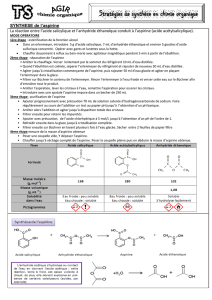
Document 1 : l’aspirine
L’aspirine est un médicament utilisé comme antalgique, antipyrétique, antiagrégant plaquettaire et anti-
inflammatoire. C’est le médicament le plus consommé au monde (environ 40 000 tonnes par an). L’aspirine ou
acide acétylsalicylique peut se décomposer dès 80ºC.
Document 2 : montages de chauffage
Chauffage à reflux
Bain marie et réfrigérant à air
Document 3 : Montage de filtration sur büchner (filtration sous pression réduite)

Activité expérimentale 1 (chapitre 14) : Synthèse de l’aspirine
Page 2 sur 7
Document 4 : Données physico-chimiques
Document 5 : rendement d’une synthèse
On appelle rendement d'une synthèse le quotient de la quantité du produit P effectivement obtenue np
par la quantité maximale attendue nmax :
max
n
np
Document 6 : recristallisation
La recristallisation est une méthode de purification des solides fondée sur la différence de solubilité du produit
et des impuretés dans un solvant.
I) LA REACTION DE SYNTHESE
Dans cette activité expérimentale nous réaliserons la réaction de synthèse de l’aspirine dont l’équation est la
suivante :

Activité expérimentale 1 (chapitre 14) : Synthèse de l’aspirine
Page 3 sur 7
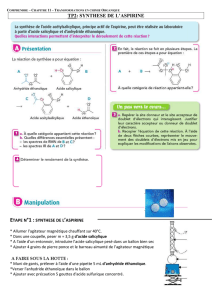
II) MODE OPERATOIRE
II-1) Réalisation de la réaction de synthèse
1. Observer les pictogrammes des réactifs utilisés (document 4). Rechercher les risques que peut
présenter leur manipulation et s’organiser en conséquence (rabat IV du livre).
2. Introduire dans un erlenmeyer bien sec de 100 mL, environ 3,5 g d’acide salicylique. Noter la masse
exacte d’acide salicylique pesée : m (as) = ……………….. . Ajouter dans l’erlenmeyer V=5,0 mL
d’anhydride acétique prélevés à l’éprouvette graduée. Ajouter avec précaution environ 5 gouttes
d’acide sulfurique concentré (utiliser le compte goutte).
3. Adapter un réfrigérant à air sur l’erlenmeyer et le placer dans un bain-marie. Chauffer pendant 20
minutes entre 60 ºC et 70 ºC (remuer de temps en temps, avec précaution, l’erlenmeyer pendant le
temps de chauffage). Pendant le chauffage commencer à répondre aux questions du paragraphe III.
4. Au bout de 20 minutes sortir l’erlenmeyer du bain marie et le laisser refroidir une minute à l’air libre
sans retirer le tube réfrigérant.
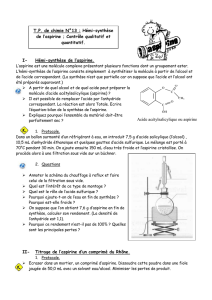
II-2) Cristallisation et purification de l’aspirine
1. Refroidir l’erlenmeyer sous l’eau du robinet.
2. AVANT DE REALISER CETTE OPERATION APPELER LE PROFESSEUR (SECURITE !!!!). PORT DE LA
BLOUSE FERMEE, DES GANTS ET DES LUNETTES DE PROTECTION OBLIGATOIRE : Ajouter très
doucement et avec précaution (risque de projections d’acide) 70 mL d’eau distillée froide afin de
détruire, d’une part, l’excès d’anhydride éthanoïque et, d’autre part, d’observer le début de
cristallisation de l’aspirine.
3. Placer l’erlenmeyer dans un bain d’eau glacée (eau + glace) pendant 10 minutes. Gratter le fond
de l’erlenmeyer avec un agitateur en verre pour favoriser la cristallisation.
4. Filtrer les cristaux obtenus sur filtre büchner (document 3) et les rincer à l’eau distillée froide.
Mettre les cristaux obtenus dans un bécher de 50 mL.
5. Prélever une pointe de spatule des cristaux obtenus et les introduire dans un tube à essai
contenant environ 5 mL d’éthanol. Dissoudre les cristaux. Avec un feutre noter ANP sur le tube à
essai (Aspirine synthétisée Non Purifiée)
6. Verser dans le bécher contenant l’aspirine 6 mL d’éthanol à 95%. Placer le bécher au bain-marie à
80°C et agiter. L’aspirine se dissout.
7. Lorsque tous les cristaux ont disparu, ajouter à la pipette graduée ou à l’éprouvette graduée 10
mL d’eau chaude pour dissoudre les impuretés et recristalliser l’aspirine.
8. Laisser refroidir environ 10 minutes sans agiter.
9. Filtrer à nouveau sur büchner et laver le précipité à l’eau froide.
10. Peser un verre de montre propre et sec : mi =………………………….
11. Sécher soigneusement l’aspirine entre deux feuilles de papier filtre. Mettre l’aspirine dans le
verre de montre. Peser le verre de montre contenant l’aspirine séchée: mf = ………………………..
12. Prélever une pointe de spatule des cristaux obtenus et les introduire dans un tube à essai
contenant environ 5 mL d’éthanol. Dissoudre les cristaux. Avec un feutre noter AP sur le tube à
essai (Aspirine synthétisée Purifiée)
II-3) Contrôle de la pureté des cristaux d’aspirine obtenus
On dispose d’un comprimé d’aspirine du commerce dissous dans l’éthanol et d’acide salicylique dissoute
dans le même solvant. On dispose de tout le matériel nécessaire pour réaliser une CCM [cuves à
chromatographie, éluant (dichlorométhane), plaques de silice pour CCM, pipettes pasteur, lampe UV,..].

Activité expérimentale 1 (chapitre 14) : Synthèse de l’aspirine
Page 4 sur 7
1. Proposer à votre professeur un protocole permettant de vérifier l’efficacité de l’opération de
purification par recristallisation des cristaux d’aspirine obtenus par synthèse.
2. Après accord de votre professeur mettre le protocole en œuvre.
III) QUESTIONS SUR LA SYNTHESE DE L’ASPIRINE
III-1) A propos de la réaction de synthèse et de sa réalisation
1. Identifier les groupes caractéristiques oxygénés présents dans les molécules d’acide salicylique et
d’acide acétylsalicylique (aspirine).
2. Identifier en annexe 2 le spectre correspondant à l’aspirine et celui correspondant à l’acide salicylique
(justifier). Vous utiliserez les tables figurant aux pages 594 et 595 de votre livre.
3. Donner le nom en nomenclature officielle du produit D (paragraphe I). A quelle famille de composés
organiques appartient-il ?
4. A quelle grande catégorie de réactions appartient la réaction de synthèse de l’aspirine ?
5. Pourquoi l’erlenmeyer utilisé doit être bien sec ?
6. Pourquoi chauffe-t-on ? Quel est le rôle de l’acide sulfurique ?
7. Indiquer les légendes correspondant aux chiffres (1) à (7) et aux lettres (a) à (g) sur les schémas de
montage de chauffage (document 2).
8. Pour le chauffage du milieu réactionnel justifiez l’utilisation du montage de chauffage au bain marie
plutôt que celui du montage de chauffage à reflux. Quel est le rôle du réfrigérant à eau ou du
réfrigérant à air ?
9. Montrer que l’acide salicylique est le réactif limitant. Calculer la quantité maximale d’aspirine
nmax(asp) que l’on pourrait obtenir.
III-2) A propos de la cristallisation et de la purification de l’aspirine
1. Expliquer pourquoi l’ajout d’eau permet de faire cristalliser l’aspirine.
2. Pourquoi l’opération de recristallisation permet-elle de purifier les cristaux d’aspirine ?
3. Déterminer le rendement de la synthèse (normalement avant d’être pesée les cristaux d’aspirine
obtenus après recristallisation auraient dus être séchés au moins 2 heures à l’étuve).
4. Analyser les résultats de la CCM. L’étape de purification par recristallisation a-t-elle été utile ? Pour
ceux qui n’auraient pas eu le temps de réaliser la CCM vous utiliserez le chromatogramme figurant
en annexe 1.
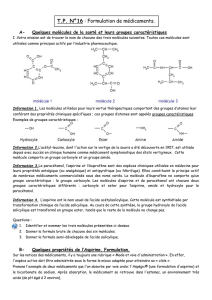
IV) D’AUTRES VOIES DE SYNTHESE POUR L’ASPIRINE (A FAIRE A LA MAISON)
Voie nº1 : Réaction classique d’estérification
Cette réaction est lente athermique et correspond à un équilibre chimique. Elle est catalysée par les ions H+.

Activité expérimentale 1 (chapitre 14) : Synthèse de l’aspirine
Page 5 sur 7
Voie nº2 : Utilisation d’un Dean Stark
La réaction est la même que celle de la voie 1 mais l’eau est éliminée au fur et à mesure de sa formation à
l’aide d’un Dean Stark (voir schéma ci-dessous). La réaction devient alors totale.
Voie nº3 : Utilisation de chlorure d’éthanoyle
L’anhydride éthanoïque que nous avons utilisé pour réaliser la synthèse de l’aspirine est remplacé par du
chlorure d´éthanoyle.
Le solvant est le dichlorométhane et la température doit être maintenue à 0ºC. De plus, une base, la
triéthylamine doit être ajoutée. La verrerie doit être sèche, et une circulation de gaz inerte comme le diazote
permet d´éviter le contact avec l’air. Prix du chlorure d’éthanoyle : 20€/L. Prix de l’anhydride éthanoïque 36€/L.
1. En comparant les avantages et les inconvénients de chacune des voies de synthèse possibles pour
l’aspirine essayer de justifier le choix fait par le professeur pour la réalisation expérimentale de cette
synthèse.
 6
6
 7
7
1
/
7
100%