Synthèse et identification de l'aspirine - Protocole de laboratoire

LGL - Laboratoire de Chimie - option 1BC
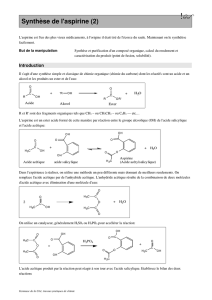
Synthèse et identification de l’aspirine
1) Objectif
On procède à une synthèse, une purification et une identification d’un composé organique
connu sous le nom aspirine.
2) Généralités
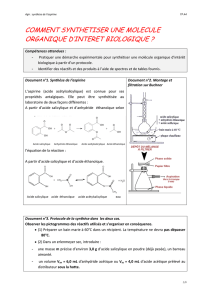
L'acide acétylsalicylique est un composé chimique utilisé comme médicament analgésique et
antipyrétique plus connu sous le nom d'aspirine, marque créée en 1899 par la société allemande
Bayer. C'est un dérivé de l'acide salicylique. Le terme salicylique vient du nom latin du saule,
dont on utilisait l'écorce pour ses propriétés curatives.
acide acétylsalicylique ou aspirine
Elle est préparée industriellement par une réaction entre l’anhydride de l’acide acétique et
l’acide salicylique:
CH3-CO-O-CO-CH3 + HO-C6H4-COOH
CH3-COO-C6H4-COOH + CH3COOH
anhydride acétique acide salicylique aspirine acide acétique
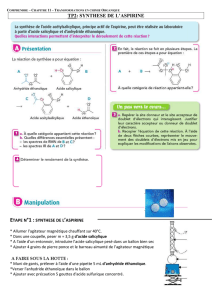
3) Modes opératoires
a. Synthèse
Peser 6 g d’acide salicylique et les introduire dans un erlenmeyer de 125 mL bien sec. Se munir
de gants et de lunettes de protection et prélever sous la hotte 10 mL d’anhydride acétique à
l’aide d’une éprouvette graduée. Les introduire dans l’erlenmeyer, puis verser quelques gouttes
d’acide sulfurique concentré. Ajouter un barreau magnétique. Surmonter l’erlenmeyer d’un
réfrigérant à air. Placer le tout dans un bain-marie thermorégulé à 60°C, pendant une vingtaine
de minutes, en maintenant une agitation douce.
Sortir l’erlenmeyer du bain-marie et le laisser quelques instants à température ambiante, avant de
le refroidir sous l’eau froide. Retirer le réfrigérant à air et introduire avec précautions, mL par
mL, 20 mL d’eau dist. glacée, en agitant à chaque ajout. Des cristaux d’aspirine apparaissent.
Placer l’erlenmeyer dans de la gace pilée pour achever la cristallisation. Réaliser une filtration
des cristaux sur Buchner en les rinçant à l’eau dist.

b. Purification
Après avoir rincé l’erlenmeyer précédent avec de l’eau dist., y introduire les cristaux obtenus,
ainsi que 6 mL d’éthanol. Porter le tout à ébullition et agiter régulièrement avec un agitateur en
verre, jusqu’à dissolution complète des cristaux d’aspirine.
Laisser l’erlenmeyer refroidir à température ambiante, avant de le plonger dans un bain de glace
pilée. Filtrer les cristaux obtenus sur Buchner et les rincer comme précédemment. Disposer les
cristaux dans une capsule préalablement pesée et placer le tout dans une étuve à 80°C pendant
10 minutes. Lorsque les cristaux sont parfaitement secs, déterminer la masse d’aspirine
synthétisée.
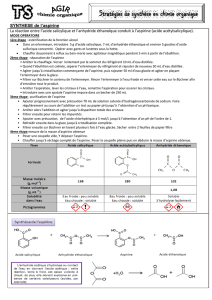
c1. Identification par CCM
Préparer l’éluant pour la chromatographie en mélangeant 6 mL d’éthanoate de butyle, 4 mL de
cyclohexane et 1 mL d’acide méthanoïque.
Verser 1 mL d’éthanoate de butyle dans trois petits tubes numérotés. Dans le tube 1, ajouter une
pointe de spatule d’acide salicylique, dans le tube 2, ajouter une pointe de spatule d’aspirine
synthétisée, dans le tube 3, ajouter une pointe de spatule d’aspirine pure.
Réaliser une CCM avec ces trois solutions.
c2. Identification par la détermination de Tfus
Déterminer le point de fusion de l’aspirine synthétisée sur banc de Kofler
c3. Identification d’une fonction chimique
Comparons la molécule de départ (l'acide salicylique) et l'aspirine (l'acide acétylsalicylique).
On constate que le groupement phénol (alcool sur noyau phényle) est remplacé par un
groupement ester. Testons l'absence de groupement phénol.
Les groupements phénol forment des complexes colorés caractéristiques avec le chlorure de
fer III suivant la réaction: FeCl3!!+!!6 ArOH!!!→ ![ Fe(OAr)6 ]H3!!+!!3 HCl
Le test sera effectué sur l'acide salicylique, un échantillon d'aspirine pure et l'aspirine
synthétisée. Préparer d’abord une solution à 2% en masse de chlorure de fer III. Dissoudre
une pointe de spatule du composé à analyser dans 3ml d'eau (ou d'un mélange eau-éthanol s'il
n'est pas soluble dans l'eau). Y ajouter 1 ml de la solution de chlorure de fer III. Agiter et
observer la coloration.
4) Questionnaire
a. Généralités
- quelles fonctions présente la molécule d’aspirine ?
- s’agit-il de l’isomère para, ortho ou méta ?
- existe-t-il un (des) isomère(s) de configuration? Motiver votre réponse.
- Rechercher quelle est masse de la production mondiale de cette substance

b. Synthèse
- pourquoi ajoute-on de l’acide sulfurique au mélange réactionnel ?
- pourquoi se sert-on d’un réfrigérant à air ?
- pourquoi apparaissent les cristaux d’aspirine lorsqu’on ajoute de l’eau glacée ?
- pourquoi réalise-t-on la recristallisation dans de l’éthanol et pas dans l’eau ?
- calcul du rendement:
c. Identification
- calculer les valeurs des Rf et tirer une conclusion:
- quelle est la température de fusion déterminée ? Conclusion:
- résultats des tests (tableau) avec la solution de fer III et conclusions:
1
/
3
100%