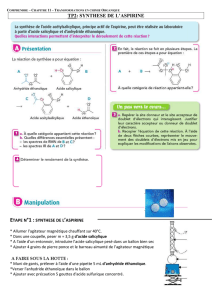
TP 7 Synthèse de l`aspirine

• 16
R-C-O-C-R
O
HO-R’
++
O
R-C-O-R’
O
R-C-OH
O
TP 7 Synthèse de l’aspirine
Agir
Stratégie de
la synthèse
organique
Pratiquer une démarche
expérimentale pour
synthétiser une molé-
cule organique d’intérêt
biologique à partir d’un
protocole
Introduction
Pendant le TP
Exemples de manipulations
L’hémisynthèse de l’aspirine est une réaction classique basée sur l’équation chimique suivante :
Lors de cette synthèse, il est important que le mon-
tage soit exempt d’eau pour éviter l’hydrolyse de
l’acide anhydride qui mènerait à un échec de la syn-
thèse.
Les synthèses organiques font l’objet de temps de
manipulation creux (temps de chauffe).
Pour mettre à prot ce temps mort, il est pos-
sible de faire quelques rappels sur les notions de
catalyse, de calcul de rendement, sur l’équation de
l’hydrolyse…
1- Montage réactionnel
2- Cristallisation
TS
le
Elle permet à l’élève d’utiliser ou de réutiliser un
nombre signicatif de techniques importantes en
chimie organique.
En effet, l’obtention des cristaux d’aspirine passe
par une étape de montage réactionnel puis de l-
tration et enn de purication.
Dans un ballon, introduire 5 g d'acide salicylique et
10 mL d'anhydride acétique.
Agiter et ajouter ensuite quelques gouttes du cata-
lyseur, l'acide sulfurique.
Placer le ballon contenant les réactifs dans le bain-
marie à 60°C et brancher le réfrigérant.
Mettre sous agitation et chauffer 20 minutes, il est
vivement recommandé aux élèves de préparer leur
compte-rendu pour ne pas être surpris par le temps
lors des prochaines étapes.
En général la cristallisation se fait en trois étapes de
refroidissement, à l’air, à l’eau et ensuite à l’eau gla-
cée. Dans le cas présent, la température de chauffe
nous permet de passer directement à la seconde
étape.
Même lors du refroidissement, il se peut que les
cristaux n’apparaissent pas, il est donc nécessaire
dans ce cas d’amener une impureté dans le milieu
en grattant le contenant avec une spatule.
16.indd 16 27/08/12 16:31

17 •
TP de Chimie
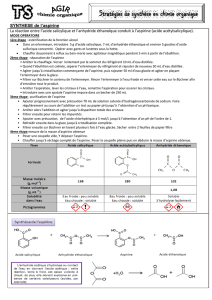
Acide salicylique (250 g) Réf. 105 169
Acide sulfurique 96 % (1 litre) Réf. 106 008
Anhydride acétique (1 litre) Réf. 106 201
Cristallisoir avec bec verseur
300 mL en Pyrex®Réf. 713 152
Erlenmeyer 100 mL - clip -
19/26 boro. 3.3 Réf. 713 702
Réfrigérant à boules à clip -
19/26 - Boro 3.3 Réf. 713 704
Matériel nécessaire Ré-
fé-
3- Filtration
4- Purification par recristallisation
Les cristaux doivent être rincés avec un sol-
vant permettant d’entraîner les impuretés
sans dissoudre les cristaux d’aspirine, dans
ce cas l’eau glacée.
Avant de mettre le mélange dans le bol du
Büchner, il est essentiel de tester l'étanchéi-
té du filtre, sous vide. Si l'étanchéité n'est
pas parfaite le "gâteau" sera entrainé par
l'eau de rinçage et se retrouvera dans le
filtrat.
Quand le "gâteau" se craque, il est consi-
déré sec.
Pour éviter un retour du filtrat dans le
"gâteau", il est préférable d'hôter le tuyau,
reliant le Büchner au vide, en fonctionne-
ment puis d'arrêter le vide.
La recristallisation purifie les cristaux d’aspi-
rine par un solvant dans lequel ils sont so-
lubles à chaud mais pas à froid.
On utilisera ici l'éthanol et on travaillera à
une température de 60°C.
Il faut, pour cette étape, ajouter le solvant
progressivement par le haut du montage à
reflux jusqu’à dissolution totale des cristaux.
Pour obtenir les cristaux, il est nécessaire de
répéter les étapes 2 et 3.
Même après cette étape, il est possible
d'obtenir des cristaux d'aspirine jaunâtres.
Cette défaillance peut être due aux produits
chimiques utilisés veillissants.
Après séchage, une CCM permet de confir-
mer le composé synthétisé et de démontrer
la qualité de la synthèse par la non-présence
de produits de réaction.
16.indd 17 27/08/12 16:31
1
/
2
100%