30332_aspirine

I- Hémi-synthèse de l’aspirine.
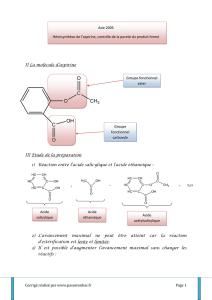
L’aspirine est une molécule complexe présentant plusieurs fonctions dont un groupement ester.
L’hémi-synthèse de l’aspirine consiste simplement à synthétiser la molécule à partir de l’alcool et
de l’acide correspondant. (La synthèse n’est que partielle car on suppose que l’acide et l’alcool ont
été préparés auparavant.)
A partir de quel alcool et de quel acide peut préparer la
molécule d’acide acétylsalicylique (aspirine) ?
Il est possible de remplacer l’acide par l’anhydride
correspondant. La réaction est alors Totale. Ecrire
l’équation-bilan de la synthèse de l’aspirine.
Expliquez pourquoi l’ensemble du matériel doit-être
parfaitement sec ?
1. Protocole.
Dans un ballon surmonté d’un réfrigérant à eau, on introduit 7,5 g d’acide salicylique (l’alcool) ,
10,5 mL d’anhydride éthanoïque et quelques gouttes d’acide sulfurique. Le mélange est porté à
70°C pendant 30 min. On ajoute ensuite 150 mL d’eau très froide et l’aspirine cristallise. On
procède alors à une filtration sous vide sur un büchner.
2. Questions
Annoter le schéma du chauffage à reflux et faire
celui de la filtration sous vide.
Quel est l’intérêt de ce type de montage ?
Quel est le rôle de l’acide sulfurique ?
Pourquoi ajoute-t-on de l’eau en fin de synthèse ?
Pourquoi est-elle froide ?
On suppose que l’on obtient 7,6 g d’aspirine en fin de
synthèse, calculer son rendement. (La densité de
l’anhydride est 1,1).
Pourquoi ce rendement n’est-il pas de 100% ? Quelles
sont les principales pertes ?
II- Titrage de l’aspirine d’un comprimé du Rhône.
1. Protocole.
Ecraser dans un mortier, un comprimé d’aspirine. Dissoudre cette poudre dans une fiole
jaugée de 50,0 mL avec un solvant eau/alcool. Minimiser les pertes de produit.
T.P. de chimie N°13 : Hémi-synthèse
de l’aspirine ; Contrôle qualitatif et
quantitatif.
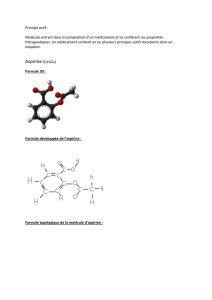
O
CH3
OH
C
C
O
O
Acide acétylsalicylique ou aspirine

Prélever 20,0 mL de cette solution à l’aide d’une pipette et l’introduire dans un bécher.
Ajouter environ 80 mL d’eau. Placer le bécher dans un bain de glace.
Préparer le titrage (suivi par conductimètrie) en remplissant la burette d’une solution
d’hydroxyde de sodium de concentration c = 1,0 .10-1 mol/L et en étalonnant le
conductimètre (réglé sur le calibre 2 mS.cm-1).
Une fois le mélange suffisamment froid, procéder au titrage (hors du bain de glace).
Tracer la courbe donnant la conductivité en fonction du volume de solution titrante
ajoutée. En déduire le volume équivalent de ce titrage.
2. Questions.
Pourquoi le solvant utilisé est-il un mélange eau/alcool ?
Pourquoi le titrage est-il effectué à température faible ?
Ecrire la réaction de titrage.
Déduire du volume équivalent obtenu, la concentration de la solution d’aspirine préparée
puis la quantité de matière d’aspirine contenu dans un comprimé.
Comparer le résultat obtenu avec les indications du fabricant.
III- Test de pureté de l’aspirine synthétisé.
Ce test sera réalisé par chromatographie sur couche mince.
1. Protocole.
Dans trois béchers, on dissout, dans le solvant éthanol, les espèces suivantes (1 seule
espèce par solution) : L’acide salicylique ; l’aspirine du commerce, l’aspirine synthétisé.
Sur une plaque de chromatographie sur couche mince, tracer une ligne de dépôt à 0,8 cm du
bord inférieur. Faire trois dépôts correspondant aux trois tubes à essais. (Nommer
distinctement les dépôts)
Procéder à l’élution. L’éluant utilisé est un mélange (acétate de butyle, cyclohexane, acide
méthanoïque) ; il doit recouvrir le fond de votre cuve à chromatographie (bécher fermé par
un verre de montre).
Arrêter l’élution lorsque le front de l’éluant est à environ 1 cm de bord supérieur de la
plaque. Noter ce front au crayon.
Révéler la plaque à la lampe UV. Noter la position des différentes tâches.
2. Questions.
Faire un schéma de la chromatographie.
Calculer les rapports frontaux de chaque tâche. (Rappel : RF = h/he <1)
Conclure sur la réussite ou non de la synthèse.
Conclure sur la pureté du produit obtenu et sur la nature des éventuelles impuretés.
Compétences expérimentales testées : T.P. chimie N°14
Non acquis
A revoir
Bonne maîtrise
Ecrire l’équation d’une estérification à partir d’un anhydride
Calculer le rendement d’une estérification
Réaliser et exploiter un titrage conductimétrique
Réaliser et exploiter une CCM

Matériel TP Aspirine :
8 groupes :
Mortier + pilon
Fiole jaugée de 50 mL
Pipette 20 mL + poire
2 béchers
Burette + porte électrode sur support
Conductimètre + pot pour solution étalon
Cristallisoir
1 cuve chromato (pot) + verre de montre + plaque de chromato + pince.
1 pissette d’eau distillée
Bureau :
3 L de mélange eau/alcool à 40/60.
110 mL d’un mélange 60 mL d’acétate de butyle, 40 mL de cyclohexane, 10 mL
d’acide méthanoïque
Lampe à UV
Comprimés d’aspirine du Rhône (18 au moins)
Soude 1,0. 10-1 (précise) 1,5 L
Solution étalon de chlorure de potassium à 10-2 mol/L
3 béchers + crayon gras
Ethanol
Acide salicylique + spatule
Glaçons (2ème heure)
Montage de chauffage à reflux avec réfrigérant à eau et un chauffage par bain
marie avec thermomètre.
Cristallisoir.
Balance au 100ème.
Acide salicylique + spatule + capsule
Anhydride éthanoïque + Eprouvette 20 mL
Acide sulfurique concentrée (en petit flacon avec compte-gouttes)
Büchner.
Eprouvette 200 mL
Glaçons (au bout de 35 min)
1
/
3
100%