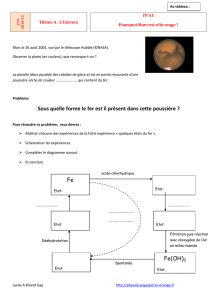
Nomenclature de 10 ième (revue)

1
La nomenclature des composés chimique
selon UICPA
http://www.defl.ca/~jdeblois2/molecules/contenu/molecules12.html
La nomenclature des composés chimiques
La nomenclature est un système utilisé en chimie pour nommer les composés.
Avant l’arrivée de ce système, on donnait des noms de personnes ou de lieux aux
produits chimiques. Avec l’accroissement des nouveaux produits chimiques, il a fallu
trouver une méthode permettant de nommer les composés en tenant compte de
leurs propriétés.
En 1919, un groupe de chimiste a fondé l’UICPA (union internationale de chimie pure
et appliquée). Cet organisme a développé un système logique et complet de
nomenclature des composés qui est utilisé dans plusieurs pays.
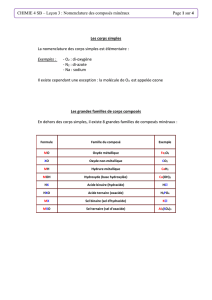
Composés binaires :
La plupart des molécules contiennent deux éléments. On les appelle des composés
binaires.
Il y a 2 possibilités
Un métal et un non-métal
Deux non-métaux
1.Comment nommer un composé binaire contenant un métal et un non-
métal?
Dans ce type de composé, on a vu que la formule donne toujours le métal suivi du
non-métal. Pour le nommer, on fait l’inverse. On part du nom du non-métal auquel
on ajoute la terminaison «ure» suivi du nom du métal.
ex :
NaCl -Chlorure de sodium
NaBr -Bromure de sodium
MgCl2 -Chlorure de magnésium
KI -Iodure de Potassium
Ca2C -Carbure de calcium (voir l’image
WC -Carbure de tungstène (super dur

2
GaN Nitrure de gallium
AlN Niture d’aluminium
InN Nitrure d’indium
CaS Sulfure de calcium
GaAs Arséniure de gallium
BN Nitrure de Bore
SiC carbure de silicium
Composé binaire contenant un métal avec valence multiples et un non-
métal
Certains éléments possèdent plusieurs nombres d’oxydations ou valences. On utilise
le nombre d’oxydation (valence) utilisé, écrit en chiffre romain que l’on place entre
parenthèse après le nom de l’élément.
Ex :
CuCl2 Chlorure de cuivre (II)
chlorure cuivrique
CuCl Chlorure de cuivre (I)
Chlorure cuivreux
FeCl3 Chlorure de fer(III) ou chlorure ferrique
FeCl2 Chlorure de fer(II) ou chlorure ferreux
PbS Sulfure de Plomb(II) ou sulfure plombeux
PbS2 Sulfure de Plomb(IV) ou sulfure plombique
SnCl4 Chlorure d'étain(IV) ou chlorure stannique
SnCl2 Chlorure d'étain(II) ou chlorure stanneux
NiF2 Fluorure de nickel(II) ou fluorure Nickeleux
NiF3 Fluorure de nickel(III) ou fluorure Nickelique
MnCl2 Chlorure de manganèse(II) ou Chlorure Manganeux
MnCl3 Chlorure de manganèse(III) ou Chlorure Manganique
Ni2S3 Sulfure de Nickel (III) ou sulfure Nickelique
NiS Sulfure de Nickel (II) ou sulfure Nickeleux

3
Exercice : composé binaire
Métal (et valence multi) + Non-Métal
1. ZnCl2 __________________________________
2. Ag2S __________________________________
3. NaF __________________________________
4. FeS __________________________________
5. CoCl3 __________________________________
6. CuCl __________________________________
7. CuCl2 __________________________________
8. CuF __________________________________
9. PbS2 __________________________________
10. Fe2S3 __________________________________
11. KBr __________________________________
12. CaH2 __________________________________
13. Mg3N2 __________________________________
14. CaC2 __________________________________
15. BaF2 __________________________________
16. BF3 __________________________________
17. LiCl __________________________________
18. MgBr2 __________________________________
19. BeS __________________________________
20. Al2S3 __________________________________
21. NaI __________________________________
22. MgCl2 __________________________________
23. FeCl2 __________________________________
24. CrCl3 __________________________________
25. CrCl6 __________________________________

4
Les oxydes binaires métaliques
Les oxydes sont des composés avec un ion positif métallique, autre que
H, et de l’ion négatif O-2.
Règle : L’oxygène est une exception aux composés binaire, il est
nommé: oxyde
Mg2+ + O2- = MgO Oxyde de magnésium
Li+ + O2- = Li2O Oxyde de lithium
Al3+ + O2- = Al2O3 Oxyde d’aluminium
Na+ + O2- = Na2O Oxyde de sodium
Oxyde avec un métal qui possède plus qu’une valence :
Hg+ + O2- = Hg2O Oxyde de mercure (I)
Hg2+ + O2- = HgO Oxyde de mercure (II)
Pb2+ + O2- = PbO Oxyde de plomb (II)
Pb4+ + O2- = PbO2 Oxyde de plomb (IV)

5
Exercice : oxyde binaire métalique
Métal (et valence multi) + oxygène
1. Fe2O3 __________________________________
2. FeO __________________________________
3. Na2O __________________________________
4. Li2O __________________________________
5. K2O __________________________________
6. CuO __________________________________
7. Cu2O __________________________________
8. RaO __________________________________
9. SrO __________________________________
10. MgO __________________________________
11. CoO __________________________________
12. Co2O3 __________________________________
13. PdO __________________________________
14. PdO2 __________________________________
15. Ru2O3 __________________________________
16. Oxyde de Nickel (II) Ni+2 + O-2 NiO
17. Oxyde de Nickel (III) _____ + _____ __________
18. Oxyde d’argent _____ + _____ __________
19. Oxyde d’or (I) _____ + _____ __________
20. Oxyde de mercure (I) _____ + _____ __________
21. Oxyde d’osmium (VI) _____ + _____ __________
22. Oxyde de Béryllium _____ + _____ __________
23. Oxyde d’or III _____ + _____ __________
24. Oxyde de Césium _____ + _____ __________
25. Oxyde de Francium _____ + _____ __________
26. Oxyde de chrome (III) _____ + _____ __________
27. Oxyde de Molybdène (V) _____ + _____ __________
28. Oxyde de Zirconium (IV) _____ + _____ __________
29. Oxyde d’aluminium _____ + _____ __________
30. Oxyde de Hafnium (IV) _____ + _____ __________
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%