Différents états de l`élément fer

Différents états de l'élément fer
I. Problématique
Mars le 26 août 2003, vue par le télescope Hubble (©NASA).
La planète Mars possède des calottes de glace et est en partie recouverte d’une
poussière sèche de couleur rouge qui contient du fer.
Sous quelle forme le fer est il présent dans cette poussière?
Comment s’est elle formée ?
II. Expérimentation
Réalisez chacune des expériences de la Fiche expérience « quelques états du fer ».
Schématisez les ’expériences sur votre cahier et décrivez vos observations.
Complétez le diagramme sur cette fiche par la formule chimique du composé obtenu, son état (en solution,
précipité, métal, poudre …) et sa couleur.
Conclure : quel est la formule chimique du composé de fer qui donne sa couleur à Mars ?
III. Prolongement
A partir des expériences réalisées, donner une définition d'un élément chimique
Le composé trouvé est l’un des constituants de la rouille.
En présence de quels réactifs la rouille se forme-t-elle ?
Qu’en déduisez-vous sur la composition de Mars dans le passé ?

Expérience 1 : action d'une solution de sulfate de cuivre sur le fer
Dans un tube à essai, versez une spatule de limaille de fer puis environ 2mL
d'une solution de sulfate de cuivre. Boucher et agiter vigoureusement au
moins 30 secondes. Il se forme des ions Fer II Fe2+
Expérience 2 : action de la soude sur les ions fer (II)
Transvaser le liquide du tube à essai précédent dans un tube propre.
Verser environ 1mL de soude 2 mol.L-1 dans le liquide. Il se forme de
l’hydroxyde de fer (II) Fe(OH)2.
Expérience 3 : action de l’air sur l’hydroxyde de fer (II)
Etaler le précipité obtenu précédemment sur une coupelle.
Attendre quelques minutes : il se forme dans un premier temps de l’hydroxyde
de fer (III) Fe(OH)3 puis celui-ci se transforme spontanément en oxyde de fer (III) hydraté Fe2O3,H2O. Ces deux
composés ont la même couleur.
Expérience 4 : déshydratation de l’oxyde de fer (III) hydraté
Placer la coupelle d’oxyde de fer (III) hydraté dans une étuve ou bien placer l’oxyde de fer (III) hydraté dans un tube
à essai et chauffer modérément à l’aide d’un bec électrique.
L’oxyde de fer (III) se déshydrate.
Expérience 5 : action de l’aluminium sur l’oxyde de fer (III) (prof)
Un mélange de poudre d’oxyde de fer et de poudre d’aluminium est placé sur une brique réfractaire ou dans un
creuset. La réaction est amorcée par la combustion d’un ruban de magnésium. Il se forme un métal incandescent qui
devient gris en refroidissant et qui est attiré par un aimant.
FICHES DE SECURITE
Soude (hydroxyde de sodium)
- Provoque de graves brûlures
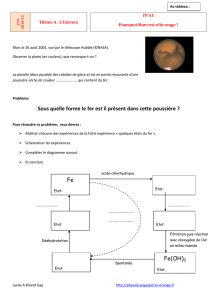
Fe
Etat: solide
Couleur :
Ion fer II Fe 2+
Etat: en solution
Couleur :
Fe(OH)3
Etat:solide
Couleur :
Oxyde de fer hydraté
Fe2O3,H2O
Etat: solide
Couleur :
Solution de soude
Filtration puis réaction
avec dioxygène de l’air
en milieu humide
Déshydratation
Aluminium
Air + eau
Spontanée
Précipité vert d’hydroxyde
de fer II Fe(OH)2
Etat: solide
Couleur :
Oxyde de fer deshydraté
Fe2O3
Etat: Solide, poudre
Couleur :
Solution de sulfate de
cuivre
Fiche expérience « quelques états du fer »

Définition de l’élément chimique :
On remarque qu’après chaque transformation, le composé obtenu contient du fer. Un élément est donc une partie
de la matière qui se conserve lors d’une transformation chimique.
La rouille se forme à partir du fer en présence d’eau et de dioxygène. C’est l’oxyde de fer hydraté. La poudre
rouge qui recouvre Mars est sèche. C’est donc de l’oxyde de fer déshydraté.
On peut donc en conclure que par le passé, on trouvait sur Mars du fer à l’état solide, mais aussi de l’eau et
du dioxygène afin que la transformation du fer en oxyde de fer déshydraté ait pu avoir lieu.
1
/
3
100%