Noms et Formules des Composés

Noms et Formules des Composés
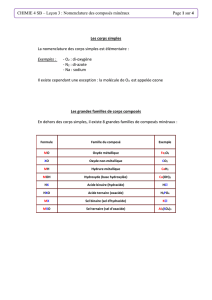
Composés binaires ioniques
Ce sont les composés ioniques qui sont formés de deux éléments différents.
Rappel: les composés ioniques sont formés d’un métal et d’un non-métal.
Comment les nomme-t-on?
Les anions se terminent en ure: F- fluorure
Cl- chlorure
Br- bromure
S2- sulfure
exception: O2- oxyde
Les cations ont le nom de l’élément: Na+ sodium
Mg2+ magnésium
Alors: NaCl chlorure de sodium
K2O oxyde de potassium
CaBr2 bromure de calcium
Comment écrit-on leurs formules?
Règles
1) les charges doivent s’annuler pour faire un composé neutre, et dans certains cas, se simplifier
2) le cation (+) s’écrit à la gauche, et l’anion (-) à la droite
chlorure de magnésium: Mg2+ Cl- MgCl2
oxyde de calcium: Ca2+ O2- CaO
phosphure de baryum: Ba2+ P3- Ba3P2
Avec les ions polyvalentes
Les métaux de transition peuvent avoir plusieurs charges, et donc, on écrit la charge du cation en chiffres romains
entre parenthèses.
Si un métal n’a qu’une seule charge, on ne l’écrit pas entre parenthèses.
Fe2+ fer (II) Cu+ cuivre (I)
Fe3+ fer (III) Zn2+ zinc
Mn4+ manganèse(IV) Ag+ argent
FeCl3 chlorure de fer (III) sulfure de cuivre (I) Cu2S
FeO oxyde de fer (II) oxyde de plomb (IV) PbO2

Composés formés d’ions polyatomiques
Ce sont des composés ioniques qui contiennent un ion formé de deux
ou plusieurs éléments.
sulfure d’ammonium: NH4+ S2- (NH4)2 S
carbonate de cuivre(II): CuCO3 Cu2+ CO32-
sulfate de sodium: Na+ SO42- Na2SO4
nitrate de sodium: Na+ NO3- NaNO3
Composés moléculaires binaires
Ce sont les composés moléculaires (liaison covalente) qui sont formés de deux éléments différents.
Rappel: les composés moléculaires sont formés de deux non-métaux.
La formule s’écrit en commençant par l’élément situé le plus à gauche dans le tableau périodique.
NO CO2 PCl5 SF6 H2O
On nomme d’abord l’élément de droite avec la terminaison yde ou ure, et avec un préfixe qui indique le nombre
d’atomes. On nomme ensuite l’élément de gauche avec un préfixe qui indique le nombre d’atomes - sauf si c’est
un seul atome.
Les préfixes sont: mono (1), di (2), tri (3), tétra (4), penta (5), hexa (6), hepta (7), octa (8), nona (9), déca (10)
NO monoxyde d’azote SF6 hexafluorure de soufre
CO2 dioxyde de carbone H2O monoxyde de dihydrogène
PCl5 pentachlorure de phosphore AsH3 trihydrure d’arsenic
Pratique - Noms et Formules des Composes
1. Nomme les composés ci-dessous.
a) MgF2 b) Na2CO3 c) K2CO3 d) NaCl e) MgBr2 f) KF
g) BeF2 h) Al2O3 i) CaCl2 j) NaI k) MgI2 l) MgO
m) BeO n) Li2S o) MnO2 p) NiBr2
2. Écris la formule chimique de chaque composé.
a)sulfate de plomb (II)
b) oxyde de fer (III)
c) sulfate d’aluminium
d) iodure de potassium
e) sulfate de cuivre (II)
f) dioxyde de carbon
g) nitrate de baryum
h) fluorure de potassium
i) carbonate de calcium
j) monoxyde de dihydrogène
k) dioxyde de carbone
l) oxyde de baryum
m) oxyde de plomb (II)
n) chlorure de cuivre (II)
o) oxyde de fer (II)
p) fluorure de nickel (II)
q) sulfure de manganèse (IV)
r) fluorure de fer (II)
s) bromure de chrome (IV)
Nom
Formule
ammonium
NH4+
hydroxyde
OH-
carbonate
CO32-
nitrate
NO3-
sulfate
SO42-
bicarbonate
HCO3-
bisulfate
HSO4-
phosphate
PO43-

3. Nomme les composés suivants:
Li2O MgI2 Al2O3 NBr3 P2O5 Rb3N SrS BF3
CrCl3 Ag2O PH3 BeH2 CBr4 NH4Cl NaOH CaCO3
KNO3 SBr6 ZnSO4 H3PO4 Sr3N2 N2O3 Cu(OH)2 FeS
4. Écris les formules des composés suivants:
a) iodure de béryllium j) trioxyde de soufre
b) monoxyde de diazote k) hydrure de calcium
c) phosphure de baryum l) dioxyde de silicium
d) bromure de cuivre (I) m) sulfure d’argent
e) fluorure de chrome(III) n) séléniure de strontium
f) nitrure de plomb (II) o) bicarbonate de sodium
g) oxyde de manganèse (IV) p) hydroxyde d’ammonium
h) sulfate de potassium q) bisulfate d’aluminium
i) oxyde de nickel (III) r) chlorure de fer (III)
EXERCICES DE NOMENCLATURE
A. Écris les formules chimiques des composés suivants:
1. chlorure d'argent
2. iodure de cuivre (II)
3. sulfate de zinc
4. fluorure de strontium
5. nitrate d'aluminium
6. oxyde de manganèse (IV)
7. nitrite de potassium
8. hydroxyde d'argent
9. nitrate de plomb (II)
10. hydroxyde de fer (III)
11. oxygène gazeux
12. trioxyde de soufre
13. chlorure d’hydrogène
14. nitrite d'aluminium
15. soufre
16. sulfate de fer (III)
17. phosphate d’hydrogène
18. fluorure de zinc
19. bicarbonate de baryum
20. sulfate d’étain (IV)
21. dioxyde d'azote
22. bisulfate d'aluminium
23. nitrite d’hydrogène
24. phosphate de zinc
25. oxyde de chrome (II)
26. brome gazeux
27. oxyde d'aluminium
28. sulfure de calcium
29. iodure de fer (III)
30. hydroxyde de magnésium
31. bromure d’hydrogène
32. nitrate d’hydrogène
33. azote gazeux
34. bisulfate de magnésium
35. dioxyde de silicium
36. sulfate d’hydrogène
37. fluor gazeux
38. sulfure d'aluminium
39. nitrite de rubidium
40. iodure d'hydrogène
41. sulfate d’ammonium
42. iodure d’hydrogène
43. tétraiodure de carbone
44. phosphore
45. bicarbonate de lithium
46. oxyde de sodium
47. carbonate de fer (III)
48. nitrate d'or (III)
49. hydroxyde de fer (II)
50. sulfure d'hydrogène
51. tétrafluorure d'uranium
52. carbonate d’hydrogène
53. carbonate d'ammonium

B. Nomme les composés suivants:
1. AgI 2. CCl4 3. CuSO4
4. MgO 5. PCl5 6. Fe(NO3)2
7. (NH4)2SO4 8. SO2 9. Cu2SO4
10. Fe(NO3)3 11. NaBr 12. AlPO4
13. K2CO3 14. Na3PO4 15. SnSO4
16. Pb(NO3)2 17. Sn(SO4)2 18. WF6
19. SO3 20. Al2(CO3)3 21. KHCO3
22. Al2S3 23. Fe(OH)2 24. HNO2
25. V2S5 26. SnF2 27. HBr
28. Zn(NO3)2 29. NH4OH 30. H2SO4
31. Cu2S 32. RbI 33. (NH4)3PO4
34. MoCl5 35. NaOH 36. Pb(HSO4)4
37. Hg(NO3)2 38. H3PO4 39. NI3
40. MnS2 41. Li2O 42. Na2SO3
43. H2S 44. H2SO3 45. CsHCO3
46. CrO 47. HF 48. HNO3
49. MnO 50. Ca(OH)2 51. CoCl2
52. PtCl4 53. HCl 54. Cr2O3
55. Al(OH)3 56. Fe2O3 57. (NH4)2HPO4
58. HI 59. PbCO3 60. Cr2(CO3)3
1
/
4
100%