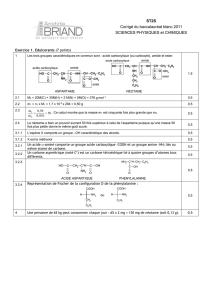
Acides carboxyliques

http://membres.lycos.fr/nico911/chorga.html 10 avril 2002
Acides carboxyliques 1 / 9
Acides carboxyliques
Généralités
Les acides carboxyliques sont des composés comprenant un hydrogène mobile (c'est-à-dire un
proton qui est acide) et un carbone électrophile succeptible de recevoir des attaques de nucléophiles.
OH
O
C
proton acide
carbone électrophile
Pour faire certaines réactions, il est parfois préférable d'utiliser des dérivés des acides
carboxyliques. Leur réactivité peut être plus grande.
H3C
H3CO
O
O
H3C
H2CO
O
O
H3C
C
l
O
R
Anhydride de l'acide éthanoïque. Ce
composé ne contient pas de H mobile,
contrairement à l'acide éthanoïque.
L'action de l'eau sur cet anhydride conduit
à la formation de deux molécules d'acide
éthanoïque.
Anhydride
mixte, ici
composé des
acides
éthanoïque et
propanoïque.
Chlorure d'acide, de façon
générale on note qu'il est
possible d'avoir accès à des
halogénures d'acides. L'action
de l'eau à pour effet de détruire
le chlorure d'acide.
Comme les alcools et les amines, les acides carboxyliques forment des liaisons hydrogènes. La
conséquence directe de ces liaisons est une augmentation de la température d'ébullition par rapport à
l'alcane correspondant.
Liaison hydrogène
O
O
RH
H
O
OR
Tableau de comparaison des températures d'ébullition :
ALCANES ALCOOLS ACIDES
CARBOXYLIQUES
Formule T eb (°C) Formule T eb (°C) Formule T eb (°C)
CH4-161.7 CH3-OH 65.0 HCOOH 100.6
CH3-CH3-88.6 CH3-CH2-OH 78.5 CH3-COOH 118.2
CH3-CH2-CH3-42.1 CH
3
-CH
2
-CH
2
-OH 97.4 CH
3
-CH
2
-COOH 141.8
Les deux liaisons hydrogènes observées dans le cas des acides carboxyliques sont telles que la
température d'ébullition est supérieure à celle des alcools.
Les effets des certains groupes sur l'acidité ne seront pas étudiés ici, pour cela se repporter au
chapitre des effets électroniques dans la section généralités.

http://membres.lycos.fr/nico911/chorga.html 10 avril 2002
Acides carboxyliques 2 / 9
Préparations des dérivés d'acides
• Chlorures d'acides : Les chlorures d'acides, sont des entités tres réactives. Il faut éviter de les mettre
dans un milieu contenant de l'eau car sinon ils dégagent de l'acide chlorhydrique et reforment l'acide
carboxylique correspondant. Ils sont très intérressants car lorsqu'ils réagissent, ils ne forment pas
d'eau, mais de l'acide chlohydrique qui peut entrer en réaction avec le milieu, ce qui peut donc être
interessant, pour la formation de certains composés. Parmi les agents de chloration on retrouve SOCl2,
PCl3, PCl5 qui permettent de chlorer un alcool, mais aussi (ClCO)2.
Cl
O
R
SOCl2
O
O
RS
O
Cl
Cl
RO
ClOS
O
Cl
OH
O
R
• Anhydrides d'acides : Les anhydrides d'acides sont aussi très réactifs, et plus réactifs que l'acide lui
même. Cet anhydride est préparé à partir de deux molécules d'acides par déshydratation ou à partir de
l'action d'un acide carboxylique sur un chlorure d'acide.
OH
O
R+Cl
O
R' R
R' O
O
O
OH
O
R+
∆
OH
O
R'
- H2O
Estérification
Les esters sont préparés par action d'une molécule d'acide carboxylique sur un alcool. Il est à noter
que plutôt que d'utiliser de l'acide carboxylique on peut aussi prendre l'anhydride d'acide, ou le chlorure
d'acide. Dans le cas d'une réaction acide - alcool, on à une réaction équilibrée il faut donc déplacer
l'équilibre vers la formation de l'ester, pour cela il existe plusieurs méthodes dont une consiste à éliminer
l'eau qui se forme au cours de la réaction, à l'aide d'un appareil de Dean-Starck. Cependant, il est
préférable de faire la réaction avec le chlorure d'acide, car la réaction est alors totale.
• Chlorure d'acide : ici dans le milieu réactionnel on introduit de la pyridine afin de pièger l'acide
chlorhydrique qui se forme.
Cl
O
R1+R2OH O
O
R1R2
O H
OClR1
R2
O H
O
R1
R2
+H
N
N H
• Anhydride d'acide : Le mécanisme invoqué est du même type. Le nucléophile (ici l'alcool) attaque sur
le carbone électrophile de l'anhydride.
OH
O
R1
R1
R1
O
O
O
++ R2OH O
O
R1R2
• Diazométhane : qui permet de faire uniquement l'ester méthylique. ATTENTION : sur le chlorure
d'acide le diazométhane forme une autre réaction, voir plus loin.
OH
O
R1+O
O
R1CH3
CH2N2

http://membres.lycos.fr/nico911/chorga.html 10 avril 2002
Acides carboxyliques 3 / 9
• Transestérification : une transestérification permet de changer l'alcool présent dans l'ester par un autre
alcool. Cette réaction marche bien pour les petits groupements tels que les groupements Methyle et
Ethyle. Ainsi il peut être possible de passer d'un ester éthylique à un ester méthylique.
+R3OH
O
O
R1R
2
+R2OH
O
O
R1R
3
H
Hydrolyse des esters
L'hydrolyse permet à partir de l'ester d'obtenir à nouveau l'acide carboxylique et l'alcool de départ.
Pour cela il existe deux possibilités : soit on travail en milieu acide, soit on travail en milieu basique.
• milieu acide (2 mécanismes admis)
• Mécanisme 1
O
O
R1R2
H
O
O
R1R2
H
O
OH
R1R2
H2OR1
OHOR2
O
H H
Prototropie
R1
OO
OH
H
R2
H
O
H
O
R1
R2OHH + +
• Mécansime 2
O
O
R1R2
H
O
O
R1R2OH
O
R1
R
2
OH
R2
H
+
alcène
+ H2O
- H
• milieu basique
O
O
R1R2OH
O
R1R2O
+
OH R1
O
OHOR2O
O
R1R2OH
+
Préparation des amides
Les amides (secondaires ou tertiaires) sont obtenus à partir d'une amine (primaire ou secondaire) et
d'un chlorure d'acide ou d'un anhydride d'acide, toujours selon le même mécanisme. C'est-à-dire que le
doublet libre de l'azote (le nucléophile) viens taper sur le carbone du dérivé carbonylé (l'électrophile). Les
amides primaires sont quand à eux obtenu à partir d'ammoniac. La réaction ne peut avoir lieu à partir
d'acide carboxylique, car elle est réversible et redonne donc l'acide et l'amine.
N H
OClR
R2
N H
O
R
R2
Cl
O
R + R2
R1
HN
R1R1N R1
O
R
R2
Les amides sont peu basiques (pKa = 17 pour le couple RCONH2/RCONH-) contrairement aux
amines (pKa = 35 pour le couple RNH2/RNH-). Cette faible basicité est due à la délocalisation de la paire
libre d'électrons sur l'atome d'azote par recouvrement avec l'orbitale π du carbonyle voisin. La paire non
liante du groupe NH2 est donc moins disponible pour former une liaison. En terme de résonance, les
amides sont plus stables et moins réactifs ques les amines parce qu'ils donnent des formes de résonances.

http://membres.lycos.fr/nico911/chorga.html 10 avril 2002
Acides carboxyliques 4 / 9
NH
O
H
NH
H
O
Toutes les amines n'ont pas un pKa aussi élever il existe une exception, c'est le cas de l'aniline (pKa =
25). Car comme pour les amides, l'aniline présente des formes de résonances. Il y a donc délocalisation
dans tout le cycle aromatique. Le doublet libre de l'azote est donc moins disponible.
NH2NH2NH2NH2
Organométalliques
• Magnésiens : Les acides carboxyliques, sont des composés comportant un proton mobile (un H acide),
ils ne peuvent donc pas réagir sur le magnésien. La réaction que l'on observe est alors une réaction
acide - base, avec formation de la base conjuguée de l'acide.
OH
O
R R1MgX
+OMgX
O
R R1H
+
NH4OH
NH4Cl
OH
O
R
STOP
Lorsque 2 équivalents de magnésien réagissent sur une fonction ester, il se forme un alcool
tertiaire. Si on ne met que 1 équivalent de magnésien, il se forme la même chose, mais la
réaction n'est plus totale, il y a donc dans le milieu de l'alcool tertaire ainsi que de l'ester qui n'a
pas réagi.
O
O
R1R2
R3MgX
1er équivalent R3
O
R1R3MgX
2ème équivalent R1
R3
R
3
OMgX
NH4OH
NH4Cl R1
R3
R
3
OH
• Lithiens : La réaction avec les lithiens est différente. Lorsque l'on ajoute 2 équivalents de lithiens, on
observe la formation d'une fonction cétone.
OH
O
R2eq CH3Li
CH3
O
R
• Cuprates : L'avantage du cuprate comparé aux magnésiens c'est qu'ici on s'arrete à la fonction cétone.
C
l
O
RR2CuLi
R
O
R
Réductions
• Réduction de la fonction acide et des fonctions dérivées.
Y
O
ROH
R
Y = OH, Cl, OR'
LiAlH4
H
O
R
OR'
O
R
CNR
DiBAlH 1eq
-78°C + H2O
O
H
O
RB2H6OH
R
La réduction par le diborane est
sélective de la fonction acide
carboxylique.

http://membres.lycos.fr/nico911/chorga.html 10 avril 2002
Acides carboxyliques 5 / 9
• Réduction des amides en amines.
N R1
O
R2
RLiAlH4
H
O
R
• Réduction sélective : On peut réduire de facon sélective une fonction acide dans une molécule
contenant une fonction acide et une fonction ester, mais on peut aussi ne réduire que la fonction ester.
COOR1
COOH
RCH2OH
COOH
R
COOR1
CH2OH
RB2H6LiHAl(OtBu)3
• Méthode de Rosemund
O
H
O
RPCl5
C
l
O
R
H
2
Pd, BaSO4
H
O
R
• Action des métaux dissous
O
O
R1R2
ou R1CN Na / EtOH OH
R1
• Réaction de duplication
OEt
O
R
2Na
OEt
O
R
O
OEt
R
O
O
R
ROEt
OEt R
R O
O
2 Na
R
R O
O R
R O
OH
Décarboxylation
La décarboxylation se produit lorsque l'on chauffe un acide. Si en β de la fonction acide, on a une
double liaison (alcène ou carbonyle) alors la décarboxylation se fait à température plus basse.
O
O
R
H
200°C R H O O
H
R O
50°C O
R
OH
R
O
HR
O
100°C HR
+CO2
Passage d'une double liaison E à une double liaison Z, par une réaction de décarbocylation :
HR
H CO2H
I
s
o
m
è
r
e
E
Br2BrR
Br CO2H
H
HR
Br HBr
HO
OBrR
I
s
o
m
è
r
e
Z
• Décarboxylationde Krapchau : La réaction de Krapchau, permet dans des conditions douces (c'est-à-
dire sans chauffer) de décarboxyler une focntion carbonyle.
O
O
OCH
3
LiI, εH2O
Collidine
OH O
• Décarboxylation radicalire : Pour de plus amples détails voir le chapitre sur la chimie radicalire. Bien
 6
6
 7
7
 8
8
 9
9
1
/
9
100%