Invagination intestinale aiguë du nourrisson et de - chu

Journal
de
pédiatrie
et
de
puériculture
(2015)
28,
118—130
Disponible
en
ligne
sur
ScienceDirect
www.sciencedirect.com
ARTICLE
EMC
Invagination
intestinale
aiguë
du
nourrisson
et
de
l’enfant夽
G.
de
Lambera,
F.
Guérina,
S.
Franchi-Abellab,
J.
Boubnovaa,
H.
Martellia,∗
aService
de
chirurgie
pédiatrique,
Hôpital
Bicêtre,
Hôpitaux
universitaires
Paris-Sud,
AP—HP,
78,
rue
du
Général-Leclerc,
94275
Le
Kremlin-Bicêtre
cedex,
France
bService
de
radiologie
pédiatrique,
Hôpital
Bicêtre,
Hôpitaux
Universitaires
Paris-Sud,
AP—HP,
78,
rue
du
Général-Leclerc,
94275
Le
Kremlin-Bicêtre,
France
MOTS
CLÉS
Invagination
intestinale
aiguë
;
Urgence
;
Lavement
pneumatique
ou
hydrostatique
;
Traitement
chirurgical
Résumé
L’invagination
intestinale
aiguë
est
la
cause
la
plus
fréquente
d’occlusion
intesti-
nale
chez
le
nourrisson
et
l’enfant
de
moins
de
2
ans.
Elle
se
définit
comme
la
pénétration
d’un
segment
d’intestin
dans
la
lumière
du
segment
qui
lui
est
immédiatement
adjacent
par
un
mécanisme
de
retournement
en
doigt
de
gant.
Elle
est
liée
à
un
trouble
du
péristaltisme
intes-
tinal
dont
l’étiologie
est
encore
mal
connue.
L’incidence
globale
de
l’invagination
varie
selon
la
zone
géographique
et
le
niveau
sanitaire.
Dans
plus
de
60
%
des
cas,
elle
survient
avant
l’âge
de
1
an.
Dans
90
%
des
cas,
elle
est
dite
idiopathique.
Dix
pour
cent
des
invaginations
intestinales
aiguës
sont
secondaires
à
une
cause
locale,
une
maladie
générale
ou
un
contexte
particu-
lier.
La
triade
classique
clinique
associe
douleurs
abdominales,
vomissements
et
rectorragies,
mais
ne
concerne
qu’un
tiers
des
patients.
La
classification
de
Brighton
définie
pour
permettre
un
recueil
standardisé
des
données
sur
l’invagination
peut
avoir
un
intérêt
clinique
pratique.
L’échographie
abdominale
est
l’examen
clé
permettant
d’affirmer
le
diagnostic.
L’invagination
intestinale
aiguë
est
une
urgence
thérapeutique.
Elle
peut
être
réduite
non
chirurgicalement
en
exerc¸ant
une
contre-pression
dans
l’intestin
d’aval
au
moyen
d’un
lavement
rétrograde
pneu-
matique
ou
hydrostatique
(en
l’absence
de
contre-indications)
ou
réduite
manuellement
par
le
chirurgien.
Le
traitement
non
chirurgical
est
efficace
dans
90
%
des
cas.
Le
traitement
chirur-
gical
(par
ciel
ouvert
ou
par
voie
laparoscopique)
est
réalisé
en
cas
de
contre-indications
au
lavement
ou
en
cas
d’échec
de
celui-ci
ou
dans
certaines
circonstances
particulières.
Le
pro-
nostic
de
cette
affection
est
excellent,
au
prix
d’une
étroite
collaboration
entre
les
différentes
équipes
pédiatrique,
chirurgicale,
radiologique
et
anesthésique.
©
2015
Publi´
e
par
Elsevier
Masson
SAS.
夽Grâce
au
partenariat
mis
en
place
en
2010
entre
le
Journal
de
pédiatrie
et
de
puériculture
et
l’EMC,
les
articles
de
cette
rubrique
sont
issus
des
traités
EMC.
Celui-ci
porte
la
mention
suivante
:
G.
de
Lamber,
F.
Guérin,
S.
Franchi-Abella,
J.
Boubnova,
H.
Martelli
Invagination
intestinale
aiguë
du
nourrisson
et
de
l’enfant.
EMC
-
Pédiatrie
-
Maladies
infectieuses
2012;(7)4:1-12
[Article
4-330-A-10].
Nous
remercions
les
auteurs
qui
ont
accepté
que
leur
texte,
publié
initialement
dans
les
traités
EMC,
puisse
être
repris
ici.
∗Auteur
correspondant.
Adresse
e-mail
:
(H.
Martelli).
http://dx.doi.org/10.1016/j.jpp.2015.04.001
0987-7983/©
2015
Publi´
e
par
Elsevier
Masson
SAS.

Invagination
intestinale
aiguë
du
nourrisson
et
de
l’enfant
119
Généralités
Définition
L’invagination
intestinale
aiguë
(IIA)
est
une
urgence
chirur-
gicale
et
la
cause
la
plus
fréquente
d’occlusion
intestinale
chez
le
nourrisson
et
l’enfant
de
moins
de
2
ans
[1].
Elle
se
définit
comme
la
pénétration
d’un
segment
d’intestin
dans
la
lumière
du
segment
qui
lui
est
immédiatement
adja-
cent
par
un
mécanisme
de
retournement
en
doigt
de
gant.
L’ensemble
formé
par
le
cylindre
externe
(invaginant),
le
cylindre
interne
(invaginé)
et
le
ou
les
cylindres
intermé-
diaires
est
connu
sous
le
nom
de
boudin
d’invagination.
Dans
la
forme
la
plus
simple,
la
zone
d’invagination
est
consti-
tuée
de
trois
cylindres
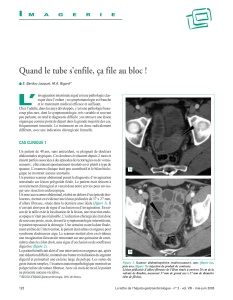
(Fig.
1).
L’IIA
débute
généralement
au
carrefour
iléocæcal
et
progresse
dans
le
côlon.
Elle
se
nomme
du
nom
du
segment
invaginé,
suivi
éventuellement
du
nom
du
segment
d’intestin
intermédiaire
entraîné
puis
du
nom
du
segment
invaginant.
Elle
est
iléocolique
dans
90
%
des
cas
[2,3]
mais
peut
être
iléo-cæco-colique,
iléo-iléale
ou
colocolique.
Elle
est
dite
iléocolique
transvalvulaire
quand
la
valvule
iléocæcale
et
l’appendice
restent
en
place
et
iléo-
cæco-colique
quand
la
valvule
iléocæcale
constitue
la
tête
de
l’invagination
entraînant
l’appendice.
Historique
La
première
description
anatomique
de
l’IIA
est
attribuée
à
Paul
Barbette
en
1674
[4].
La
première
intervention
cura-
trice
fut
réalisée
en
1871
par
Jonathan
Hutchinson
[5].
En
1876,
Hirschsprung
fut
le
premier
à
rapporter
une
série
sur
la
réduction
hydrostatique
dans
l’IIA
par
réduction
[6].
L’utilisation
diagnostique
et
thérapeutique
du
lavement
opaque
fut
rapportée
en
1927
en
France
par
Pouliquen
[7],
aux
États-Unis
par
Retan
et
Stephens,
et
en
Scandinavie
par
Olsson
et
Pallin
[8].
Épidémiologie
L’incidence
globale
de
l’IIA
varie
selon
la
zone
géographique
et
le
niveau
sanitaire.
Dans
les
pays
industrialisés,
son
Figure
1.
Boudin
d’invagination.
1.
Boudin
d’invagination
;
2.
segment
d’aval,
3.
méso
;
4.
segment
d’amont
;
5.
sens
du
péris-
taltisme.
incidence
est
évaluée
entre
0,5
et
4,3
cas
pour
1000
naissances
vivantes
ou
entre
0,66
et
1,2
cas
pour
1000
enfants
de
moins
de
1
an,
alors
que
dans
les
pays
en
voie
de
développement
cette
incidence
est
plus
élevée
[9].
Dans
95
%
des
cas,
l’IIA
survient
pendant
les
deux
premières
années
de
vie.
Dans
plus
de
60
%
des
cas,
elle
survient
avant
l’âge
de
1
an
avec
un
pic
entre
3
et
8
mois
[3,10].
Elle
est
exceptionnelle
en
anténatal
(entraînant
une
atrésie
intestinale)
et
chez
le
nouveau-né.
Le
sexe
masculin
est
un
facteur
prédisposant
d’IIA
et
représente
60
%
des
cas
[11].
Il
n’a
pas
de
preuve
de
variation
saisonnière
[9].
Éthiopathogénie
L’IIA
est
liée
à
un
trouble
du
péristaltisme
intestinal
dont
l’étiologie
est
encore
mal
connue.
Dans
la
plupart
des
cas,
elle
est
dite
idiopathique.
L’obstacle
en
cause
serait
l’hypertrophie
des
plaques
de
Peyer
d’origine
virale
dans
la
région
iléocæcale.
Les
argu-
ments
en
faveur
de
cette
hypothèse
sont
:
le
fait
que
l’IIA
se
développe
le
plus
souvent
au
carrefour
iléocæcal,
région
riche
en
tissu
lymphoïde
;
la
prédominance
mas-
culine
sachant
que
le
tissu
lymphoïde
est
plus
important
chez
le
garc¸on
que
chez
la
fille
;
la
quantité
de
tissu
lym-
phoïde
qui
est
maximale
au
niveau
du
carrefour
iléocæcal
au
cours
des
premiers
mois
de
la
vie.
Les
récentes
études
sur
la
vaccination
à
rotavirus
à
grande
échelle
[12—15],
la
présence
d’adénovirus
dans
les
selles
[9,16],
dans
les
ganglions
mésentériques
ou
dans
l’appendice
associée
de
manière
significative
à
l’IIA
[17]
sont
d’autres
arguments.
Des
infections
au
virus
de
l’herpès
[18]
et
à
Yersinia
entero-
colitica
[19]
ainsi
que
des
parasitoses
[20]
ont
également
été
rapportées.
L’infection
virale
elle-même
serait
responsable
d’une
augmentation
du
péristaltisme
intestinal
favorisant
l’invagination.
L’allaitement
maternel
[21]
et
les
antibio-
tiques
[22]
ont
également
été
impliqués.
Certaines
IIA
sont
secondaires
à
une
cause
locale,
une
maladie
générale
ou
un
contexte
particulier.
Elles
se
voient
à
tout
âge
de
la
vie
(mais
surtout
chez
l’enfant
de
plus
de
5
ans)
[23]
et
en
tout
point
du
tube
digestif.
Elles
sont
également
à
rechercher
en
cas
de
récidive.
Physiopathologie
Le
péristaltisme
intestinal
fait
progresser
le
boudin
vers
l’aval,
entraînant
également
le
méso
et
les
vaisseaux
qui
sont
étranglés.
Cette
progression
est
facilitée
par
les
défauts
d’accolements
coliques
et
n’est
limitée
que
par
la
longueur
de
la
racine
du
mésentère.
La
compression
au
niveau
du
collet
entraîne
une
stase
veineuse
et
lymphatique
avec
un
œdème
qui
majore
la
compression,
interrompant
le
flux
artériel
et
pouvant
entraîner
des
lésions
de
la
muqueuse
intestinale
(avec
émission
de
sang
par
l’anus),
voire
la
nécrose
de
la
paroi
intestinale
et
la
perforation
en
cas
de
délai
diagnostique
[1,24].
La
compression
des
nerfs
entraînent
les
phénomènes
douloureux
paroxystiques
de
l’IIA.
Parfois,
cette
striction
est
peu
importante
malgré
plusieurs
jours
d’évolution
expliquant
la
bonne
tolérance
clinique.
La
désinvagination
spontanée
est
également
pos-
sible
[25].
Un
cas
exceptionnel
a
été
décrit
en
1962
avec
gangrène
de
l’intestin
invaginé
puis
fusion
et
rétablissement

120
G.
de
Lamber
et
al.
de
la
continuité
digestive
[26]
et
guérison
sans
sténose
séquellaire.
Clinique
Il
faut
non
seulement
faire
le
diagnostic
de
l’IIA
mais
égale-
ment
évaluer
la
gravité
de
la
situation.
Interrogatoire
Il
recherche
les
circonstances
de
survenue
:
le
début
des
symptômes,
les
facteurs
favorisants
comme
la
notion
d’un
épisode
infectieux
oto-rhino-laryngologique
(ORL)
récent,
des
antécédents
de
douleurs
abdominales,
le
terrain
(notion
de
maladie
générale
ou
contexte
particulier).
L’âge
de
l’enfant
est
un
élément
important
à
prendre
en
compte.
Il
s’agit
généralement
d’un
enfant
en
bonne
santé
et
sans
antécédent.
Les
symptômes
cardinaux
de
l’IIA
sont
les
douleurs
abdo-
minales,
les
vomissements
et
les
rectorragies.
Cette
triade
classique
a
une
valeur
prédictive
positive
de
93
%
[27]
mais
elle
ne
concerne
que
7,5
à
40
%
des
patients
[28—30].
Les
douleurs
abdominales
violentes
paroxystiques
se
manifestent
par
des
crises
douloureuses
de
survenue
brutale
avec
accès
de
pleurs,
de
sueurs
et
de
pâleur.
L’enfant
replie
ses
genoux
sur
son
abdomen.
Ces
crises
cessent
au
bout
de
quelques
minutes
aussi
brutalement
qu’elles
ont
débuté.
Entre
les
crises,
l’enfant
se
comporte
normalement.
Elles
se
répètent
avec
une
fréquence
et
une
intensité
variables.
Elles
peuvent
être
isolées
dans
15
%
des
cas
[31]
mais
peuvent
également
être
absentes
jusque
dans
20
%
des
cas
[2,11],
notamment
chez
le
nourrisson
de
moins
de
4
mois
[32].
Les
vomissements
alimentaires
accompagnent
souvent
la
première
crise
mais
ne
sont
pas
constants
lors
des
crises
suivantes.
Ce
sont
souvent
les
premiers
symptômes
chez
le
nourrisson
de
moins
de
4
mois
[32].
Le
refus
du
biberon
est
un
signe
quasi
constant.
Les
vomissements
bilieux
signent
l’occlusion
dans
les
formes
vues
tardivement
ou
une
forme
anatomique
particulière
(invagination
iléo-iléale
haute
ou
jéjunojéjunale).
Les
émissions
de
sang
par
l’anus
sont
une
caractéristique
majeure
de
l’IIA.
Lorsqu’elles
signent
la
congestion
vei-
neuse,
les
selles
sont
typiques
et
dites
en
gelée
de
groseille
(sang
et
excès
de
mucus).
Des
rectorragies
plus
importantes
ou
du
méléna
peuvent
être
le
signe
d’une
nécrose
de
la
paroi
intestinale.
Du
sang
peut
également
être
retrouvé
au
tou-
cher
rectal
à
l’examen
clinique.
Une
diarrhée
sanglante
doit
faire
évoquer
une
cause
infectieuse.
Les
Tableaux
1
et
2
montrent
la
classification
de
Brighton
définie
pour
permettre
un
recueil
standardisé
des
données
sur
l’IIA
[33].
La
classification
peut
avoir
un
intérêt
clinique
pratique
même
si
la
démarche
diagnostique
reste
la
même.
Examen
clinique
L’inspection
permet
d’apprécier
le
retentissement
de
l’IIA
sur
l’état
général
de
l’enfant
:
fièvre,
déshydratation,
asthé-
nie,
hypotonie,
léthargie.
Cette
dernière
traduit
la
réaction
vagale
liée
à
l’invagination
et
est
prédictive
d’IIA
[34,35],
notamment
chez
le
nourrisson
de
moins
de
1
an
[3].
Les
troubles
hémodynamiques
sont
rares
et
tardifs.
Tableau
1
Critères
majeurs
et
mineurs
utilisés
dans
la
définition
des
cas
d’IIA
(classification
de
Brighton).
Critères
majeurs
Critères
mineurs
Signes
d’obstruction
intestinale
(un
ou
plusieurs
des
signes
suivants)
Vomissements
bilieux
À
l’examen
clinique
:
distension
abdominale
aiguë
ou
absence
de
bruits
hydro-aériques
À
l’ASP
:
niveaux
hydro-aériques
et
dilatation
anses
intestinales
Signes
d’IIA
(un
ou
plusieurs
des
signes
suivants)
Masse
abdominale
ou
rectale
Prolapsus
rectal
ASP
révélant
une
invagination
ou
masse
des
tissus
mous
visible
Échographie
révélant
une
invagination
ou
masse
des
tissus
mous
visible
TDM
révélant
une
invagination
ou
masse
des
tissus
mous
visible
Signes
de
congestion
veineuse
(un
ou
plusieurs
des
signes
suivants)
Rectorragies
Selles
en
gelée
de
groseille
Sang
au
toucher
rectal
Facteurs
prédisposants
:
âge
<
1
an
et
sexe
masculin
Douleurs
abdominales
Vomissements
Léthargiea
Pâleurb
Choc
hypovolémiqueb
ASP
:
répartition
anormale
mais
non
spécifique
des
gaz
intestinaux
IIA
:
invagination
intestinale
aiguë
;
ASP
:
abdomen
sans
préparation
;
TDM
:
tomodensitométrie.
aSi
les
vomissements
sont
bilieux,
ils
ne
peuvent
pas
être
comp-
tés
deux
fois
comme
critères
majeur
et
mineur.
bLéthargie
et
pâleur
surviennent
généralement
de
fac¸on
intermittente
en
association
avec
des
douleurs
abdominales
spasmodiques.
Chez
les
patients
présentant
une
IIA
sévère
ou
prolongée,
la
léthargie
et
la
pâleur
peuvent
devenir
un
trait
constant
associé
à
une
dégradation
de
l’état
cardiovasculaire
et
au
risque
imminent
de
choc
hypovolémique.
La
palpation
recherche
une
vacuité
de
la
fosse
iliaque
droite
(FID)
et
une
masse
mobile
palpable
située
sur
le
cadre
colique
sensible,
voire
douloureuse
(25—50
%)
correspondant
au
boudin
d’invagination
qui
se
situe
dans
l’hypochondre
droit
s’étendant
vers
le
côlon
transverse
jusque
dans
le
côlon
descendant,
voire
le
rectum
jusqu’au
prolapsus
rectal.
Ce
signe
est
plus
présent
dans
les
pays
en
voie
de
dévelop-
pement
(7
%)
que
dans
les
pays
développés
(1,5
%)
[1].
L’examen
clinique
abdominal
recherche
un
météorisme
abdominal
évoquant
l’occlusion
ou
bien
des
signes
en
faveur
d’une
complication
péritonéale.
Le
toucher
rectal
peut

Invagination
intestinale
aiguë
du
nourrisson
et
de
l’enfant
121
Tableau
2
Niveaux
de
certitude
du
diagnostic
proposés
par
la
collaboration
de
Brighton.
Niveau
1
(cas
certain)
Mise
en
évidence
de
l’IIA
:
—IIA
visible
à
la
chirurgie
(critère
chirurgical)
—IIA
au
lavement
pneumatique
ou
hydrostatique
ou
masse
typique
à
l’échographie
dont
la
réduction
est
prouvée
(critères
radiologiques)
—IIA
retrouvée
à
l’autopsie
Niveau
2
(cas
probable)
Critères
cliniques
:
—2
critères
cliniques
majeurs
ou
—1
critère
majeuraet
3
critères
mineurs
Niveau
3
(cas
possible)
Critères
cliniques
:
au
moins
4
critères
mineurs
Niveau
4Informations
insuffisantes
(moins
de
4
critères
mineurs)
Niveau
5
(non-cas) Suspicions
réfutées
IIA
:
invagination
intestinale
aiguë.
aSi
le
critère
majeur
est
l’émission
de
sang
par
le
rectum
et
qu’il
est
associé
à
une
selle
diarrhéique,
évoquer
le
diagnostic
de
diarrhée
infectieuse.
Dans
ce
cas,
rechercher
deux
critères
majeurs.
compléter
l’examen
à
la
recherche
de
rectorragies
ou
du
boudin.
La
fièvre
est
présente
dans
21
à
35
%
des
cas
[11],
en
rapport
avec
le
contexte
infectieux
ou
évoquant
des
complications,
ou
bien
apparaissant
au
décours
de
l’épisode
d’IIA.
L’examen
clinique
recherche
également
des
signes
en
faveur
d’une
forme
secondaire
:
purpura,
masse
abdomi-
nale,
lentiginose
périorificielle,
etc.
Formes
cliniques
L’IIA
est
primitive
et
idiopathique
dans
90
%
des
cas.
Dans
les
autres
cas,
la
présentation
clinique
dépend
de
l’étiologie
de
l’IIA.
Invaginations
intestinales
aiguës
idiopathiques
du
nourrisson
Elles
représentent
10
à
20
%
des
IIA.
La
forme
classique
est
très
typique.
Les
formes
à
symptomatologie
incomplète
sont
fréquentes
et
trompeuses
car
elles
mettent
un
symptôme
inhabituel
au
premier
plan
qui
retarde
le
diagnostic
et
la
prise
en
charge
thérapeutique
:
•formes
entérocolitiques
avec
diarrhée
fébrile
(10
%
des
cas)
;
•formes
hémorragiques
avec
rectorragies
importantes
fai-
sant
évoquer,
à
tort,
le
diagnostic
de
diverticule
de
Meckel
hémorragique
;
•formes
occlusives
pouvant
correspondre
à
une
invagina-
tion
iléo-iléale
;
•formes
avec
boudin
extériorisé
:
dans
le
cas
de
l’IIA,
il
existe
un
espace
laissant
passer
un
abaisse-langue
entre
le
boudin
et
le
canal
anal
[36].
Elles
ne
contre-indiquent
pas
un
traitement
par
lavement
;
•formes
pseudoméningées
où
les
symptômes
neurologiques
sont
au
premier
plan
(hypotonie,
convulsions,
altération
de
la
conscience)
[34,35]
orientant
vers
une
méningite
ou
une
hypertension
intracrânienne.
La
normalité
du
liquide
céphalorachidien
doit
faire
évoquer
la
possibilité
d’une
IIA.
Quels
que
soient
les
signes
cliniques,
il
importe,
chez
un
nourrisson
âgé
de
2
mois
à
2
ans,
d’évoquer
le
diagnostic
d’IIA
et
de
réaliser
une
échographie
abdominale.
Invaginations
intestinales
aiguës
secondaires
Elles
représentent
moins
de
10
%
des
IIA
[10,23,37]
mais
leur
fréquence
augmente
avec
l’âge
de
l’enfant
[10]
et
sont
favo-
risées
par
une
cause
locale,
une
maladie
générale
ou
un
contexte
particulier.
Cause
locale
•le
diverticule
de
Meckel
:
une
IIA
est
responsable
de
50
%
des
formes
occlusives
[38]
;
•les
tumeurs
:
il
peut
s’agir
de
tumeurs
bénignes
:
angiomes,
polype
isolé,
juvénile
ou
hamartomateux
[39],
polypes
multiples
dans
le
cadre
d’une
polypose
juvénile
ou
d’un
syndrome
de
Peutz-Jeghers
[40].
Dans
le
syn-
drome
de
Peutz-Jeghers,
les
IIA
sont
jéjunojéjunales
ou
iléo-iléales
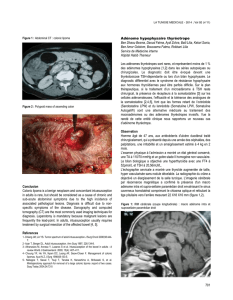
(Fig.
2).
Elles
conduisent
souvent
à
des
laparo-
tomies
itératives
avec
résections
aboutissant
parfois
à
des
Figure
2.
Aspect
peropératoire
d’une
invagination
intestinale
aiguë
sur
polype
dans
le
cadre
d’un
syndrome
de
Peutz-Jeghers.

122
G.
de
Lamber
et
al.
grêles
courts
[41].
Il
faut
rechercher
à
l’examen
clinique
une
lentiginose
périorificielle
au
niveau
de
la
bouche
et
de
l’anus.
L’atteinte
des
muqueuses
chez
l’enfant
est
quasi
constante.
Pendant
la
laparotomie
pour
IIA,
il
faut
recher-
cher
d’autres
polypes
non
encore
symptomatiques,
soit
par
entéroscopie
peropératoire,
soit
par
palpation.
Des
tumeurs
malignes,
sarcomes
ou
lymphomes
peuvent
éga-
lement
être
à
l’origine
d’une
IIA
[42,43].
Dans
ce
cas,
les
symptômes
peuvent
évoluer
depuis
quelques
semaines
et
être
associés
à
une
perte
de
poids
[23].
Trente-trois
à
55
%
des
lymphomes
non
hodgkiniens
de
l’enfant
se
présentent
comme
une
urgence
abdominale,
l’IIA
en
étant
le
mode
révélateur
le
plus
fréquent
[42]
;
•les
malformations
digestives
:
duplications,
hétérotopies
pancréatiques
ou
gastriques
;
•l’appendicite
[44]
;
•les
sondes
de
gastrojéjunostomie
[23,45].
Maladie
générale
•Le
purpura
rhumatoïde
:
une
IIA,
iléo-iléale
ou
iléo-
colique,
est
diagnostiquée
dans
3
à
10
%
des
cas
de
purpura
rhumatoïde
[46].
Les
IIA
transitoires
sont
pro-
bablement
beaucoup
plus
fréquentes,
responsables
en
partie
des
manifestations
douloureuses
abdominales.
Cela
doit
conduire
à
rechercher
systématiquement
un
pur-
pura,
notamment
au
niveau
des
chevilles
et
dans
les
espaces
interorteils
des
grands
enfants
qui
ont
des
dou-
leurs
abdominales
paroxystiques.
Le
diagnostic
de
cette
complication
reste
cependant
difficile
car
les
crises
douloureuses
qui
font
partie
du
tableau
du
purpura
rhu-
matoïde
sont
parfois
inaugurales
avant
l’apparition
du
purpura.
Leur
traitement
est
controversé,
pour
certaines
équipes
conservateur
[46]
avec
corticothérapie
[47],
et
pour
d’autres
chirurgical
[48],
reposant
sur
l’évolution
cli-
nique,
radiologique
et
échographique.
•La
mucoviscidose
:
une
IIA,
le
plus
souvent
iléo-cæco-
colique,
touche
1
%
des
patients
et
est
secondaire
à
une
impaction
de
selles.
La
réduction
par
lavement
à
l’air
ou
à
la
gastrografine,
chez
un
enfant
réhydraté,
a
supplanté
le
traitement
chirurgical
[49].
Une
mucocèle
appendicu-
laire
peut
également
être
à
l’origine
d’une
invagination
intestinale
récidivante
[50].
•Autres
:
troubles
de
la
coagulation,
hémophilie,
maladie
cœliaque
[51].
Contexte
•L’IIA
chez
le
nouveau-né
:
elle
est
exceptionnelle
et
géné-
ralement
induite
par
la
présence
d’une
malformation
intestinale
[52,53].
Le
tableau
clinique
est
celui
d’une
occlusion
basse
du
grêle.
L’association
à
une
rectorragie
ou
la
palpation
d’un
boudin
oriente
le
diagnostic
qui
n’est,
le
plus
souvent
réalisé,
qu’à
l’intervention.
Cette
patho-
logie
a
également
été
décrite
chez
le
prématuré
où
la
présentation
clinique
simule
fréquemment
une
entéroco-
lite
ulcéronécrosante
[54—56].
•En
postopératoire
:
l’IIA
est
dans
la
majorité
des
cas
iléo-
iléale
ou
jéjunojéjunale.
Elle
est
décrite
dans
0,08
à
0,5
%
des
laparotomies
et
survient
préférentiellement
après
toute
chirurgie
modifiant
les
rapports
anatomiques,
en
particulier
après
la
chirurgie
rétropéritonéale
avec
grands
décollements,
les
exérèses
de
masses
volumineuses
ou
bien
en
cas
de
cure
de
hernie
diaphragmatique
[23,57]
dans
les
deux
semaines
postopératoires.
Un
iléus
postopé-
ratoire
prolongé
ou
l’apparition
d’un
syndrome
occlusif
après
reprise
du
transit
fait
envisager
le
diagnostic
et
conduit
à
l’échographie.
Le
traitement
est
le
plus
souvent
chirurgical
[58]
car
l’IIA
concerne
l’intestin
grêle.
•La
chimiothérapie
:
les
enfants
en
cours
de
chimiothéra-
pie,
notamment
sous
méthotrexate,
peuvent
présenter
des
troubles
du
péristaltisme
ainsi
que
des
épaississe-
ments
de
la
paroi
intestinale
favorisant
la
survenue
d’IIA
volontiers
iléo-iléales.
Le
diagnostic
est
particulièrement
difficile
en
raison
du
caractère
souvent
subaigu
des
mani-
festations
cliniques
et
de
la
fragilité
de
ces
patients
[59].
•Le
postvaccin
à
rotavirus
[12—15].
Point
fort
Formes
atypiques
d’invagination
intestinale
aiguë
•Clinique
trompeuse
:
formes
digestives,
neurologiques
•Âge
trompeur
:
nouveau-né
ou
enfant
•Terrain
trompeur
:
IIA
postopératoire,
sur
purpura
rhumatoïde,
sur
mucoviscidose
•Délai
trompeur
:
formes
vues
précocement
ou
tardivement
Examens
complémentaires
Une
fois
le
diagnostic
suspecté,
la
réalisation
des
examens
complémentaires
doit
se
faire
chez
un
enfant
réhydraté
et
analgésié.
Échographie
L’échographie
est
l’examen
diagnostique
de
choix
avec
une
sensibilité
et
une
valeur
prédictive
négative
proches
de
100
%
et
une
spécificité
de
88
à
100
%,
même
dans
des
mains
expertes
[24,27,60,61].
Elle
comporte
un
balayage
complet
de
l’abdomen
avec
une
sonde
curvilinéaire
de
fréquence
moyenne
(4—7
MHz)
et
un
balayage
des
structures
digestives
par
une
sonde
haute
fréquence
(≥
7
MHz)
qui
permettra
de
mieux
caractériser
le
boudin
d’invagination.
La
grande
majorité
des
IIA
se
localise
dans
la
région
sous-hépatique
droite.
Tous
les
sec-
teurs
de
l’abdomen
doivent
être
explorés,
la
tête
du
boudin
d’invagination
pouvant
arriver
jusqu’au
rectum.
Un
boudin
d’invagination
iléocolique
ou
colocolique
mesure
entre
3
et
5
cm
de
diamètre
et
se
situe
sous
la
paroi
abdominale.
Il
s’agit
donc
d’une
masse
«
facile
»
à
déceler
en
échographie.
Les
invaginations
grêlogrêliques
ont
la
même
sémiologie
mais
leur
diamètre
est
inférieur
(<
3
cm),
leur
locali-
sation
est
plutôt
centrale
ou
dans
le
flanc
gauche
et
leur
détection
parfois
plus
difficile
[60].
Elles
sont
rare-
ment
secondaires
[62].
Elles
se
réduisent
spontanément
en
quelques
minutes
dans
la
très
grande
majorité
des
cas
[62],
notamment
lorsqu’elles
sont
de
petit
diamètre
(<
2
cm),
de
moins
de
3,5
cm
de
long
avec
une
vascularisation
nor-
male
au
Doppler
et
sans
œdème
de
la
paroi
[63,64].
Chez
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%