Réaction d`oxydoréduction : exemple de l`oxydation des alcools

Terminale S - AP SPC 4
Objectifs : Reconnaitre la classe d’un alcool
Connaitre l’oxydant et le réducteur d’un couple redox (ox / red)
Ecrire des équations d’oxydoréduction
1/ L’oxydation des alcools
Voici quelques extraits d’articles scientifiques:
Document 1 : La butanone est un liquide d’odeur assez agréable entrant dans la composition de peintures, de
colles et d’agents nettoyants. Dans la nature, elle se trouve à l’état de traces dans certains fruits.
On en obtient 1,5g en oxydant 2,0g de butan-2-ol par 3,0g d’acide hypochloreux HClO. Les couples rédox
intervenant au cours de cette transformation sont HClO(aq)/Cl-(aq) et butanone/butan-2-ol.
Document 2 : Au laboratoire, la bouteille de benzaldéhyde est souvent utilisée : elle est
donc ouverte et fermée à de nombreuses reprises. Une bouteille entamée depuis plusieurs
semaines présente un dépôt blanc sur son col dont le point de fusion est à 122°C.
Alcool benzylique
Benzaldéhyde
Acide benzoïque
Acide salicylique
Tfusion = -15°C
Tfusion = -26°C
Tfusion = 122°C
Tfusion = 159°C
Document 3 : Le Taxotère est une molécule efficace pour lutter contre certains cancers. Au début des années
1960, devant le nombre toujours croissant de cancers, des équipes de chercheurs se sont penchées sur
l’obtention de molécules aux propriétés anticancéreuses. Après avoir passé au crible bon nombre d’espèce
végétales, des botanistes et chimistes remarquent que l’écorce de l’If du Pacifique contient une molécule
intéressante : le taxol […] Au cours de l’élaboration du
taxol, les scientifiques imaginent une autre molécule,
deux fois plus efficace mais présentant moins d’effets
secondaires : le Taxotère dont voici une des étapes de
la synthèse :
Document 4 : Après oxydation du 2-méthylpropan-2-ol, un élève réalise deux tests caractéristiques. Lors du
test à la 2,4DNPH, aucun précipité ne se forme. Quant à celui à la liqueur de Fehling, le liquide demeure bleu.
Rappel : Tests caractéristiques :
La 2,4-dinitrophénylhydrazine (2,4-DNPH) caractérise la présence de la fonction carbonyle. Protocole :
introduire dans 1mL de 2,4-DNPH 2/3 gouttes de solution à tester. Apparition d’un précipité jaune orangé.
Le test au réactif de Tollens caractérise la présence d’aldéhyde. Protocole : introduire dans 1mL de réactif de
Tollens 2/3 gouttes de solution à tester. Chauffer. Apparition d’un dépôt gris caractéristique.
Le test à la liqueur de Fehling met en évidence la présence d’aldéhyde. Protocole : introduire dans 1mL de
liqueur de Fehling 2/3 gouttes de solution à tester. Chauffer. Apparition d’un précipité rouge brique d’oxyde de
cuivre.
Réaction d’oxydoréduction : exemple de
l’oxydation des alcools

Q1 : Donner la formule semi-développée des alcools dont il est question dans les documents 1-3-4.
Q2 : Quelle est la classe de ces alcools ?
Q3 : Remplir le tableau suivant :
Classe de l’alcool
Famille du produit de
l’oxydation
Famille à laquelle appartient le
produit de l’oxydation ultérieure
Q4 : Ecrire les couples puis les demi-équations redox faisant intervenir alcool, aldéhyde, cétone et acide
carboxyliques vus dans les documents précédents.
…………………... / …………………... ………………………………………………………………………………………………………………….
…………………... / …………………... ………………………………………………………………………………………………………………….
…………………... / …………………... ………………………………………………………………………………………………………………….
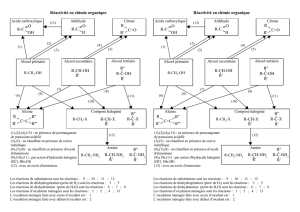
Rappel : Le carbone qui porte le groupe hydroxyle OH, peut être liés à un, deux ou trois autres atomes de
carbone (appelés groupe alkyle).Ce nombre de groupe alkyle définit la classe de l’alcool :
Rappel : Un oxydant est une espèce chimique capable de capter un ou plusieurs électrons.
Un réducteur est une espèce chimique capable de céder un ou plusieurs électrons.
Un couple oxydant/réducteur est l’ensemble d’un oxydant et d’un réducteur capables de
s’échanger un ou plusieurs électrons. On note alors les deux espèces conjuguées : Ox/Réd.
La demi-équation rédox : L’échange d’électrons possible entre un oxydant et son réducteur conjugué se
note à avec une demi-équation : Ox + n e- Red
La demi-équation doit vérifier la conservation des éléments et des charges.Ce n’est qu’une écriture formelle,
car les électrons n’existent pas en solution.
Méthode générale pour l’écriture des demi-équations redox
Vérifier la conservation des éléments (autre que H et O).
La conservation de l’élément oxygène est assuré avec les molécules d’eau (solvant)
Celle de l’élément hydrogène est assurée par les ions hydrogène H+(aq) en milieu acide.
Celle des charges est assurée par les électrons.

2/ Equilibrer une équation d’oxydoréduction
Q5 : A l’aide du document 1 et de la Q4, déterminer l’équation d’oxydation du butan-2-ol en butanone :
…………………... / …………………... ………………………………………………………………………………………………………………….
…………………... / …………………... ………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………….
Q6 : Le benzaldéhyde est oxydé par l’oxydant du couple MnO4-(aq) / Mn2+(aq), établir l’équation d’oxydation du
benzaldéhyde
…………………... / …………………... ………………………………………………………………………………………………………………….
…………………... / …………………... ………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………….
Q7 : Entrainez-vous seuls :
Au cours de ce protocole, nous nous proposons de passer d’un alcool, l’octan-2-ol à l’octan-2-one, une
hormone sécrétée par certaines fourmis. Cette transformation appelée oxydation ménagée de
l’octan-2-ol est réalisée par l’ion tétrathionate qui appartient au couple redox : S4O62-(aq)/S2O32-(aq). […]
Ecrire l’équation de la réaction chimique.
………………………………………………………………………………………………………………….………………………………………………………
………………………………………………………….………………………………………………………………………………………………………………
….………………………………………………………………………………………………………………….……………………………………………………
La transformation chimique utilisée dans un alcootest est une réaction d oxydoréduction. L'alcool
C2H6O réagit avec des ions dichromate Cr2O72-. Ecrire l’équation de la réaction chimique.
Données : Cr2O7 2-(aq)/ Cr3+(aq) ; C2H4O2 / C2H6O
………………………………………………………………………………………………………………….………………………………………………………
………………………………………………………….………………………………………………………………………………………………………………
….………………………………………………………………………………………………………………….……………………………………………………
Rappel : Une réaction d’oxydoréduction est un transfert d’électrons entre l’oxydant d’un couple
Ox1/Red1 et le réducteur d’un autre couple Ox2/Red2.
L’oxydant Ox1 va subir une réduction et le réducteur Red2 va subir une oxydation.
Une oxydation est une perte d’électron. Une réduction est un gain d’électrons.
L’équation de la réaction redox s’obtient à l’aide des demi-équations redox sachant que les électrons
transférés ne doivent pas y apparaître.
Ox1 + n1 e- Red1 ( × n2) ( reduction)
Red2 Ox2 + n2 e- ( × n1) ( oxydation)
n2 Ox1 + n1 Red2 → n2 Red1 + n1 Ox2

Terminale S - AP SPC 4 - CORRECTION
Objectifs : Reconnaitre la classe d’un alcool
Connaitre l’oxydant et le réducteur d’un couple redox (ox / red)
Ecrire des équations d’oxydoréduction
1/ L’oxydation des alcools
Q1 : Donner la formule semi-développée des alcools dont il est question dans les documents 1-3-4.
Q2 : Quelle est la classe de ces alcools ? Secondaire / primaire / tertiaire
Q3 : Remplir le tableau suivant :
Classe de l’alcool
Famille du produit de
l’oxydation
Famille à laquelle appartient le
produit de l’oxydation ultérieure
Alcool I
Aldehyde
Acide carboxylique
Alcool II
Cétone
/
Alcool III
/
/
Q4 : Ecrire les couples puis les demi-équations redox faisant intervenir alcool, aldéhyde, cétone et acide
carboxyliques vus dans les documents précédents.
butanone/butan-2-ol C4H8O + 2 H+(aq) + 2e- C4H10O
Acide benzoïque / Benzaldéhyde C7H6O2 + 2 H+(aq) + 2e- C7H6O + H2O
C8H10O / C8H12O C8H10O + 2 H+(aq) + 2e- C8H12O
Réaction d’oxydoréduction : exemple de
l’oxydation des alcools

2/ Equilibrer une équation d’oxydoréduction
Q5 : A l’aide du document 1 et de la Q4, déterminer l’équation d’oxydation du butan-2-ol en butanone :
C4H8O + 2 H+(aq) + 2e- butanone/butan-2-ol C4H10O
H2O(l) + Cl-(aq) HClO(aq)/Cl-(aq) HClO(aq) + H+(aq) + 2e-
C4H10O + HClO(aq) C4H8O + H+(aq) + H2O(l) + Cl-(aq)
Q6 : Le benzaldéhyde est oxydé par l’oxydant du couple MnO4-(aq) / Mn2+(aq), établir l’équation d’oxydation du
benzaldéhyde
Acide benzoïque / Benzaldéhyde C7H6O + H2O C7H6O2 + 2 H+(aq) + 2e- (×5)
MnO42- (aq) / Mn2+(aq) MnO42- + 8 H+ + 5 e- Mn2+ + 4 H2O (×2)
5 C7H6O + 2 MnO42-(aq) + 6 H+(aq) 5 C7H6O2 + 2 Mn2+(aq) + 3 H2O(l)
Q7 : Entrainez-vous seuls :
Au cours de ce protocole, nous nous proposons de passer d’un alcool, l’octan-2-ol à l’octan-2-one, une
hormone sécrétée par certaines fourmis. Cette transformation appelée oxydation ménagée de
l’octan-2-ol est réalisée par l’ion tétrathionate qui appartient au couple redox : S4O62-(aq)/S2O32-(aq). […]
Ecrire l’équation de la réaction chimique.
S4O62-(aq)/S2O32-(aq) S4O62-(aq) + 2e- 2S2O32-(aq)
C8H16O / C8H18O C8H18O C8H16O+ 2 H+(aq) + 2e-
S4O62-(aq) + C8H18O 2S2O32-(aq) + C8H16O + 2 H+(aq)
La transformation chimique utilisée dans un alcootest est une réaction d oxydoréduction. L'alcool
C2H6O réagit avec des ions dichromate Cr2O72-. Ecrire l’équation de la réaction chimique.
Données : Cr2O7 2-(aq)/ Cr3+(aq) ; C2H4O2 / C2H6O
Cr2O7 2-(aq)/ Cr3+(aq) Cr2O7 2-(aq) + 14 H+(aq) + 6e- 2Cr3+(aq) + 7H2O(l) (×2)
C2H4O2 / C2H6O C2H6O + H2O(l) C2H4O2 + 4H+(aq) + 4e- (×3)
2Cr2O7 2-(aq) + 16 H+(aq) + 3C2H6O 4Cr3+(aq) + 11H2O(l) + 3C2H4O2
1
/
5
100%