Syndrome du bébé secoué - chu

Journal
de
pédiatrie
et
de
puériculture
(2012)
25,
158—164
Disponible
en
ligne
sur
www.sciencedirect.com
ARTICLE
EMC
Syndrome
du
bébé
secoué夽
D.
Renier
Service
de
neurochirurgie-pédiatrique,
hôpital
Necker-Enfants-malades,
149,
rue
de
Sèvres,
75743
Paris
cedex
15,
France
MOTS
CLÉS
Hématome
sous-dural
;
Maltraitance
;
Hémorragies
rétiniennes
;
Crises
comitiales
;
Séquelles
cognitives
Résumé
Le
syndrome
du
bébé
secoué
associe,
chez
un
nourrisson,
un
hématome
sous-dural
et
des
hémorragies
rétiniennes,
sans
histoire
de
traumatisme.
Il
se
manifeste
par
une
apathie,
une
irritabilité,
des
vomissements
ou,
plus
souvent,
par
une
crise
convulsive,
qui
peut
se
répéter
ou
se
prolonger.
Ces
crises
comitiales,
lorsqu’elles
se
répètent
ou
se
prolongent,
mettent
en
jeu
le
pronostic
vital.
Le
traitement
vise
à
prévenir
la
récidive
des
convulsions
et
à
évacuer
l’hématome,
par
ponction
ou
dérivation.
Le
pronostic
neurologique
est
sombre
:
une
majorité
de
ces
enfants
présenteront
des
séquelles
neuropsychologiques.
On
attribue
ce
saignement
sous-dural
à
une
déchirure
de
veines
péricérébrales
lors
de
secousses
violentes,
intentionnelles
(maltraitance)
ou
liées
à
un
comportement
inadapté
en
réponse,
par
exemple,
à
des
pleurs
prolongés
ou
répétés
de
l’enfant.
©
2012
Publié
par
Elsevier
Masson
SAS.
Introduction
Le
syndrome
du
bébé
secoué
(shaken
baby
syndrome)
entre
dans
le
cadre
des
traumatismes
non
accidentels
du
nourrisson.
Autrement
dit,
des
traumatismes
infligés,
par
maltraitance
ou
comportement
inadapté.
L’association
d’un
hématome
sous-dural
et
d’hémorragies
rétiniennes
chez
le
nourris-
son,
caractéristique
de
ce
syndrome,
a
été
décrite
en
1930
par
Sherwood
[1],
mais
ne
sera
rapportée
à
des
secousses
qu’en
1972
par
Caffey,
qui
crée
le
terme
de
«
syndrome
du
bébé
secoué
»
[2].
夽Grâce
au
partenariat
mis
en
place
en
2010
entre
le
Journal
de
pédiatrie
et
de
puériculture
et
l’EMC,
les
articles
de
cette
rubrique
sont
issus
des
traités
EMC.
Celui-ci
porte
la
mention
suivante
:
Renier
D.,
Syndrome
du
bébé
secoué,
Pédiatrie
-
Maladies
infectieuses,
4-002-G-50,
2010.
Nous
remercions
les
auteurs
qui
ont
accepté
que
leur
texte,
publié
initialement
dans
les
traités
EMC,
puisse
être
repris
ici.
Adresse
e-mail
:
0987-7983/$
—
see
front
matter
©
2012
Publié
par
Elsevier
Masson
SAS.
doi:10.1016/j.jpp.2012.03.005

Syndrome
du
bébé
secoué
159
Chez
le
nourrisson,
le
traumatisme
crânien,
accidentel
ou
non,
est
(de
loin)
le
plus
fréquent
des
traumatismes.
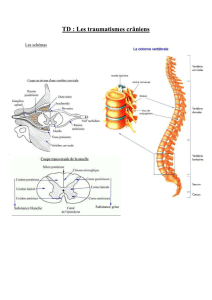
L’hématome
sous-dural
est
la
lésion
la
plus
commune
de
ce
type
de
traumatisme.
C’est
un
saignement
de
veines
situées
entre
le
cerveau
et
les
méninges.
Il
siège
le
plus
souvent
au
niveau
de
la
convexité
cérébrale
et
le
long
de
la
faux
du
cerveau,
bilatéral
ou,
moins
sou-
vent,
unilatéral.
Il
peut
également
siéger
en
arrière,
sous
l’encéphale,
au
niveau
de
la
tente
du
cervelet.
Cette
collection
sanguine
est
parfois
assez
importante
pour
pro-
voquer
une
anémie,
car
la
masse
sanguine
du
nourrisson
est
petite.
La
pâleur
en
est
le
signe.
D’autre
part,
elle
constitue
un
volume
supplémentaire
occupant
de
l’espace
dans
la
boîte
crânienne,
comprimant
et
irritant
le
cer-
veau,
pouvant
provoquer
une
hypertension
intracrânienne,
des
déficits
neurologiques
ou
-
plus
souvent
-
des
crises
convulsives
[3,4].
Manifestations
cliniques
Le
mode
de
début
le
plus
fréquent,
observé
dans
trois
quarts
des
cas,
est
la
crise
comitiale.
Il
s’agit
le
plus
souvent
d’une
crise
unique,
mais
elle
n’est
pas
facile
à
reconnaître
car
les
clonies
des
membres
ou
de
la
face
manquent
souvent.
Les
témoins
de
la
crise
décrivent
«
un
malaise
»
de
survenue
brutale.
Lui
succèdent
des
troubles
de
la
conscience
d’intensité
variable,
allant
de
la
som-
nolence
au
coma.
À
l’examen,
on
observe
une
pâleur
et
un
bombement
de
la
fontanelle.
Le
périmètre
crânien
est
au-dessus
de
la
moyenne.
On
recherche
un
déficit
moteur
hémicorporel.
La
survenue
d’un
trouble
aigu
de
la
conscience
chez
un
nourrisson
impose
son
hospitalisation
immédiate
en
soins
intensifs,
la
mise
en
route
d’un
solide
traitement
anti-
convulsivant,
et
la
réalisation
d’une
tomodensitométrie
crânienne.
Il
s’agit
de
prévenir
de
nouvelles
crises
comi-
tiales,
et
plus
encore
la
survenue
d’un
état
de
mal
convulsif,
événement
grave
et
non
exceptionnel
puisqu’on
l’observe
dans
20
%
des
cas.
Cette
crise
prolongée
qui
réa-
lise
l’état
de
mal
peut
durer
plusieurs
heures
en
l’absence
de
traitement.
Elle
peut
survenir
d’emblée,
constituant
l’entrée
dans
la
maladie.
Il
s’agit
d’un
événement
gravis-
sime,
qui
laisse
des
séquelles
lourdes
dans
la
majorité
des
cas.
À
l’opposé,
certains
modes
de
présentation
sont
moins
spectaculaires,
avec
des
troubles
du
comportement
(agita-
tion,
apathie)
associés
à
des
vomissements
répétés
qui
vont
égarer
vers
une
pathologie
digestive.
Là
encore,
le
diagnos-
tic
sera
redressé
sur
la
constatation
d’un
périmètre
crânien
excessif
(et
qui
a
subi
au
cours
des
dernières
semaines
une
poussée
anormale),
d’une
fontanelle
bombée
et,
parfois,
d’une
pâleur.
Dans
tous
ces
cas,
le
diagnostic
d’hématome
sous-dural
(aigu
ou
subaigu)
doit
être
évoqué
et
la
tomosensitométrie
crânienne
réalisée
sans
délai.
L’examen
clinique
complet
recherche
des
traces
cutanées
de
traumatisme
(hématomes,
ecchymoses,
griffures,
blessures,
brûlures),
que
l’on
note
soigneusement
en
mentionnant
si
elles
sont
d’âges
dif-
férents,
et
que
l’on
photographie.
On
trouve
ces
lésions
cutanées
dans
un
quart
des
cas.
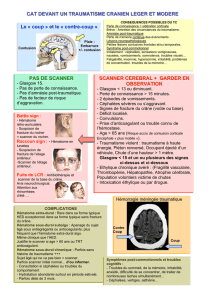
Examens
complémentaires
Tomodensitométrie
(Fig.
1)
•Le
diagnostic
d’hématome
sous-dural
repose
sur
la
tomo-
densitométrie
crânienne.
•Elle
en
précise
le
siège,
le
plus
souvent
frontopariétal
et
interhémisphérique,
le
volume
et
le
côté.
Le
plus
souvent,
l’hématome
est
bilatéral.
•Elle
permet
d’évaluer
approximativement
sa
date
de
survenue,
en
fonction
de
sa
densité
:
hyperdensité
pour
l’hématome
récent
(quelques
jours),
hypodensité
pour
l’hématome
plus
ancien
(environ
1
semaine,
et
plus).
L’hématome
récent
s’accompagne
souvent
d’une
hémorragie
méningée,
représentée
par
des
hyperdensités
visibles
dans
les
sillons
corticaux.
•Elle
montre
aussi
les
conséquences
de
cet
hématome
sur
le
tissu
cérébral.
L’effet
de
masse
est
apprécié
par
le
refoulement
du
parenchyme,
qui
est
mesurable.
L’existence
d’une
hypodensité
du
parenchyme
céré-
bral
sous
l’hématome
est
importante
à
apprécier
:
elle
représente
une
souffrance
cérébrale,
et
s’observe
en
par-
ticulier
après
les
crises
comitiales,
surtout
si
elles
se
sont
prolongées.
Elle
est
de
mauvais
pronostic.
On
recherche
aussi
des
lésions
extracrâniennes
:
œdème
ou
hématome
sous-cutané,
peu
fréquentes
en
l’absence
de
traumatisme
avéré.
Examen
du
fond
d’œil
Des
hémorragies
rétiniennes
sont
retrouvées
dans
les
deux
tiers
des
cas
[5].
Elles
signent
pratiquement
le
diagnostic
de
bébé
secoué
:
ces
hémorragies
sont
en
effet
exceptionnelles
dans
les
trau-
matismes
avérés
(accident
de
la
route,
chute
d’un
lieu
élevé,
etc.)
[6].
L’importance
de
leur
reconnaissance
rend
l’examen
du
fond
d’œil
indispensable
;
il
est
réalisé
autant
que
possible
par
un
ophtalmologiste
averti
[7].
Elles
sont
bilatérales
le
plus
souvent.
Dans
10
%
des
cas,
on
observe
des
hémorragies
rétiniennes
d’âges
différents.
Électroencéphalogramme
(EEG)
L’amplitude
du
tracé
EEG
est
asymétrique
en
cas
d’hématome
sous-dural
unilatéral
ou
prédominant
d’un
côté.
Il
faut
surtout
rechercher
des
anomalies
comitiales
:
foyer
de
pointes
ou
de
pointes
ondes,
voire
état
de
mal
infraclinique,
non
exceptionnel.
Cet
examen
apporte
également
des
éléments
d’appréciation
du
pronostic
fonctionnel.
Dans
1
%
des
cas,
l’EEG
est
inactif
(tracé
plat).
Radiographies
du
squelette
complet
Systématiquement,
en
présence
d’un
hématome
sous-dural
chez
un
nourrisson,
il
faut
réaliser
un
bilan
radiologique
complet
du
squelette.
Il
s’agit
de
rechercher
des
fractures
associées,
qu’on
observe
dans
un
quart
des
cas.
Elles
siègent
pour
moitié
des
cas
au
niveau
des
membres,
et
pour
les
autres
au
niveau
des
membres
et
du
thorax.

160
D.
Renier
Dans
10
%
des
cas
environ,
elles
sont
multiples,
et
il
faut
alors
noter
si
elles
sont
d’âges
différents.
Ces
fractures
sont
le
plus
souvent
non
déplacées.
Les
radiographies
du
squelette
complet
permettent
par
ailleurs
de
rechercher
une
ostéogenèse
imparfaite,
circons-
tance
très
rare
dans
le
cadre
des
hématomes
sous-duraux,
mais
qu’on
ne
peut
évidemment
pas
ignorer.
Bilan
sanguin
L’étude
de
l’hémostase
est
systématique,
mais
elle
est
rarement
anormale
:
thrombopénie
et
hémophilie
ont
été
observées.
En
revanche,
l’anémie
est
pratiquement
cons-
tante,
sévère
dans
la
majorité
des
cas
(hémoglobine
inférieure
à
8
g/dl).
Très
exceptionnellement,
on
peut
découvrir
une
maladie
métabolique
ignorée
jusqu’à
présent,
comme
par
exemple
l’acidurie
glutarique
de
type
I.
Au
moindre
doute,
une
élec-
trophorèse
des
acides
aminés
est
à
demander.
Diagnostic
différentiel
Le
seul
diagnostic
différentiel
de
l’hématome
sous-dural
du
nourrisson
est
constitué
par
la
collection
sous-durale
bénigne,
appelée
parfois
«
hydrocéphalie
externe
».
Cette
collection,
qui
est
constituée
de
liquide
céphalorachidien,
est
située
autour
de
l’encéphale,
en
particulier
dans
la
région
frontale.
Elle
n’a
aucune
répercussion
neuropsy-
chologique.
Elle
est
reconnue
sur
une
tomodensitométrie
crânienne
demandée
à
l’occasion
d’une
poussée
exces-
sive
de
périmètre
crânien,
habituellement
aux
alentours
de
5
mois.
Il
s’agit
d’une
collection
hypodense.
Elle
est
deux
fois
plus
fréquente
chez
les
garc¸ons
que
chez
les
filles
(comme
l’hématome
sous-dural)
et
il
est
possible
que
cette
collection,
en
mettant
sous
tension
les
veines
corticodurales
qui
la
traversent,
constitue
un
facteur
favorisant
la
surve-
nue
d’hématomes
sous-duraux
à
l’occasion
de
secousses
qui,
dans
ce
cas,
n’auraient
pas
besoin
d’être
aussi
violentes
que
dans
la
«
vraie
»
maltraitance,
mais
ceci
reste
à
démontrer.
Figure
1.
Syndrome
du
bébé
secoué.
Enfant
âgé
de
6
mois
vu
aux
urgences
pour
malaise,
convulsions
et
hémiplégie
gauche.
A
à
D.
Scanner
le
jour
du
malaise.
Hémorragie
de
la
tente
du
cervelet
(A,
B).
Hématome
sous-dural
hémisphérique
droit
avec
effet
de
masse
:
effacement
des
sillons
cérébraux
et
du
ventricule
latéral
droits.
Hémorragie
interhémisphérique
(C).
Hémorragies
des
sillons
à
droite,
au
niveau
du
vertex
et
de
la
faux
du
cerveau,
épaisse
et
irrégulière.
Effacement
des
sillons
cérébraux
à
droite
(D).
E
à
G.
Imagerie
par
résonance
magnétique
10
jours
plus
tard,
séquences
pondérées
en
T1.
Confirmation
rétrospective
des
hémorragies
de
la
tente
du
cervelet,
de
l’espace
interhémisphérique
et
de
l’hématome
hémisphérique
sous-dural
droit,
marquées
par
des
hyperintensités.

Syndrome
du
bébé
secoué
161
Figure
1.
(Suite
).
Traitement
Réanimation
La
découverte
d’un
hématome
sous-dural
chez
un
nourris-
son
impose
une
hospitalisation
en
secteur
de
soins
intensifs
sans
délai.
Il
s’agit
d’assurer
une
surveillance
de
tous
les
instants,
dans
la
crainte
de
la
survenue
d’une
crise
comi-
tiale
ou
d’un
état
de
mal
épileptique,
toujours
à
craindre
et
ceci
d’autant
plus
que
l’hématome
est
plus
récent,
c’est-à-
dire
hyperdense
à
la
tomodensitométrie.
Ceci
est
impératif
quelle
que
soit
la
taille
de
l’hématome,
même
s’il
est
peu
ou
pas
compressif,
et
surtout
quand
il
s’accompagne
d’hyper-
densités
sous-arachnoïdiennes
le
long
des
sillons
corticaux.
Dans
les
cas
les
plus
graves,
l’intubation
et
la
ventilation
assistée
s’imposent.
Le
traitement
antiépileptique
est
évi-
demment
de
mise,
en
mono-
ou
en
bithérapie.
L’utilisation
de
penthotal
est
parfois
indispensable
(état
de
mal
comi-
tial).
Traitement
chirurgical
Ponction
transfontanellaire
Il
s’agit
d’un
geste
simple
qui
permet
l’évacuation
de
l’hématome.
À
la
suite
de
cette
ponction,
la
surveillance
clinique
(tension
de
la
fontanelle)
et
tomodensitométrique
permet
de
déterminer
si
ce
geste
est
suffisant,
ce
qui
est
le
cas
le
plus
fréquent.
Dérivation
Si
la
fontanelle
redevient
bombante
et/ou
si
la
tomo-
densitométrie
montre
la
persistance
d’une
collection
importante,
la
mise
en
place
d’une
dérivation
s’impose.
En
cas
d’hématome
récent
(rouge
à
la
ponction),
il
s’agit
d’une
dérivation
sous-durale
externe.
Au
bout
de
quelques
jours,
lorsque
l’épanchement
drainé
s’éclaircit
et
devient
xantho-
chromique,
la
dérivation
externe
est
retirée.
Quelquefois,
ce
drainage
est
suffisant.
Dans
les
autres
cas,
une
dériva-
tion
sous-duropéritonéale
doit
être
mise
en
place
[8].
La
surveillance
ultérieure,
clinique
et
tomodensitométrique,
permet
de
déterminer
la
date
à
laquelle
cette
dérivation
interne
peut
être
retirée,
le
plus
souvent
vers
le
troisième
mois
postopératoire.
Cette
ablation
est
un
geste
chirurgical
simple
qui
ne
nécessite
que
48
heures
d’hospitalisation.
Évolution
et
pronostic
Le
pronostic
des
hématomes
sous-duraux
chez
le
nourrisson
est
sévère,
tant
sur
le
plan
vital
que
sur
le
plan
neuropsy-
chologique
[9—11].
Le
taux
de
mortalité
est
de
8
%.
L’âge

162
D.
Renier
est
un
facteur
de
mortalité
important
:
les
moins
de
3
mois
ont
un
risque
trois
fois
plus
important
que
les
plus
âgés.
Un
autre
facteur
de
risque
vital
est
la
survenue
d’un
état
de
mal
comitial
:
dans
cette
circonstance,
la
mortalité
est
dix
fois
plus
élevée,
passant
de
2,4
%
à
24
%
en
cas
d’état
de
mal.
Le
pronostic
fonctionnel
est
également
sombre.
Les
séquelles
neurologiques
sont
fréquentes
et
lourdes
:
épi-
lepsie
(en
particulier
spasmes
en
flexion),
déficits
cognitifs
et
moteurs,
débilité
mentale
sont
malheureusement
fré-
quents.
Là
encore,
l’existence
d’un
état
de
mal
comitial
est
un
facteur
majeur
du
pronostic
:
la
majorité
de
ces
enfants
auront
des
séquelles
sévères
[12].
Des
séquelles
moins
lourdes
sont
observées
chez
environ
la
moitié
des
autres.
L’âge
est
également
un
facteur
de
pronostic
fonc-
tionnel
majeur
:
parmi
les
moins
de
3
mois,
plus
d’un
enfant
sur
deux
présentera
de
lourdes
séquelles
neurologiques.
Enfin,
il
faut
noter
que
la
fréquence
de
ces
séquelles,
en
particulier
les
retards
de
développement
neuropsycholo-
gique,
ne
se
précise
bien
souvent
que
tard,
à
partir
de
7
ans,
au
moment
de
la
scolarité
élémentaire
[13].
Aspects
psychosociaux
L’origine
des
hématomes
sous-duraux
du
nourrisson,
sauf
exception
rarissime,
est
toujours
traumatique.
Le
problème
est
que
le
traumatisme
causal
n’est
dans
la
grande
majo-
rité
des
cas
pas
retrouvé
à
l’interrogatoire
des
parents
:
soit
il
est
inavoué,
soit
il
est
passé
inaperc¸u.
On
comprend
bien
que
le
responsable
puisse
cacher
sa
faute
ou
sa
mal-
adresse.
La
question
est
de
déterminer
autant
que
possible
si
-
justement
-
il
s’agit
d’une
maladresse
ou
d’une
agres-
sion
(intentionnalité).
Mais
il
peut
paraître
étrange
qu’un
traumatisme
crânien
puisse
passer
inaperc¸u.
C’est
que
le
mécanisme
peut
ne
pas
être
un
traumatisme
au
sens
commun
du
terme
:
un
choc
direct
(une
chute,
l’impact
d’un
objet
tombé
ou
contondant).
Beaucoup
plus
souvent,
il
s’agit
en
effet
de
simples
secousses
pouvant,
lors
des
mouvements
de
va-et-vient
de
la
tête
du
nourrisson,
pro-
voquer
une
déchirure
par
cisaillement
de
certaines
veines
unissant
la
surface
du
cerveau
aux
méninges.
Pour
certains
auteurs
cependant,
ces
secousses
doivent
s’accompagner
d’un
impact
pour
provoquer
un
saignement
:
après
avoir
été
secoué,
le
nourrisson
est
brutalement
laissé
tombé
sur
le
plan
du
lit
[14].
L’espace
qui
sépare
le
cerveau
des
méninges
est
très
petit,
sauf
chez
le
nourrisson
où,
particulièrement
autour
de
l’âge
de
6
mois,
et
plus
encore
chez
les
garc¸ons
que
chez
les
filles,
il
s’élargit.
Ainsi
les
veines
ont-elles
un
trajet
plus
long
entre
cerveau
et
méninges,
ce
qui
les
fra-
gilise
et
explique
que
des
mouvements
apparemment
peu
traumatiques
puissent
les
menacer
[15,16].
Appelé
au
chevet
d’un
nourrisson
traumatisé
du
crâne,
le
médecin
doit
pratiquer
ses
soins,
bien
sûr,
mais
il
lui
faut
aussi
s’interroger
sur
ce
qui
a
pu
arriver.
La
question
est
grave
et
difficile
[17].
Elle
est
grave
parce
que,
forcé-
ment,
un
tiers
est
responsable.
Elle
est
difficile
parce
que
l’événement
en
cause
n’est
pas
toujours,
tant
s’en
faut,
intentionnel,
mais
peut
très
bien
avoir
été
vécu
comme
tout
à
fait
anodin.
La
question
est
ici
tout
à
fait
particulière
car
cette
patho-
logie
neurochirurgicale
touche
des
bébés
de
quelques
mois
qui
ne
pourront
jamais
expliquer
les
circonstances
du
trau-
matisme.
Le
médecin
se
trouve
donc
dans
une
situation
extrê-
mement
délicate
:
celle
d’avoir
la
responsabilité
morale
de
protéger
un
bébé
-
nous
en
examinerons
les
diffé-
rentes
modalités
(cf.
infra).
Comment
déterminer
si
la
lésion
constatée
est
le
produit
d’une
inconséquence
ou
d’une
brutalité
intentionnelle
?
Une
constellation
d’éléments
cli-
niques
discrets
doit
alors
être
recherchée
systématiquement
en
se
fondant
sur
les
données
recueillies
par
les
médecins,
les
psychologues
et
les
assistantes
sociales.
À
cet
âge
(3
à
8
mois)
où
la
tête
est
mal
mainte-
nue
par
un
cou
fragile,
point
n’est
besoin
d’un
choc
violent
pour
entraîner
la
rupture
de
vaisseaux
sanguins
cérébraux.
Un
geste
qui
peut
paraître
anodin
pour
cer-
tains
peut
provoquer
une
lésion
grave
aux
séquelles
parfois
incurables.
Démêler
la
part
de
l’accidentel,
de
l’inconséquence
et
de
l’intentionnel
permet
de
trouver
la
meilleure
solution
pour
venir
en
aide
à
la
famille
et
prévenir
les
récidives.
Il
s’agit
là
d’une
véritable
enquête
qui
doit
se
fonder
sur
de
nombreux
éléments
(médicaux,
psychologiques,
sociaux)
qui
supposent
une
équipe
multidisciplinaire.
Véritable
enquête
:
enquête
policière
?
Puisqu’on
évoque
la
possibilité
d’un
trau-
matisme
infligé
(une
«maltraitance
»),
le
problème
se
pose
aussitôt
du
signalement
judiciaire.
C’est
une
des
questions
importantes.
Nous
tenterons
d’en
donner
des
éléments
de
réponse
(cf.
infra).
Dans
un
premier
temps,
il
s’agit
de
déterminer
comment
le
traumatisme
est
survenu
et
qui
est
responsable.
Dans
l’esprit
du
médecin
et
de
l’équipe
psychosociale,
le
but
prin-
cipal
est
de
préserver
l’avenir
(prévention
de
la
récidive),
et
non
de
pénaliser
;
la
place
du
judiciaire
est
à
ce
stade
au
second
plan
-
ou
plutôt
la
question
en
est
différée
(en
fait,
nous
verrons
que
sur
ce
point,
médecins,
magistrats
et
policiers
ont
des
analyses
différentes).
Que
se
passe-t-il
?
Un
nourrisson
est
amené
à
l’hôpital,
envoyé
par
son
pédiatre
ou
amené
par
ses
parents
ou
sa
nourrice,
le
plus
souvent
dans
un
climat
d’urgence.
Les
pre-
miers
soins
sont
souvent
lourds,
spectaculaires.
On
parle
de
réanimation,
de
soins
intensifs,
de
chirurgie.
Dans
ce
contexte,
le
premier
contact
avec
la
famille
est
particu-
lièrement
précieux.
Que
s’est-il
passé
?
Quand
?
Qui
?
Ce
dialogue
est
poursuivi
dans
les
jours
qui
suivent,
avec
tous
les
membres
de
l’équipe.
Ce
dialogue
n’est
pas
facile,
entre
des
professionnels
qui
doivent
se
garder
de
projections
négatives
sur
les
familles
(ou
à
l’inverse
d’une
identifica-
tion
fallacieuse),
éviter
la
banalisation
ou
la
dramatisation
excessives,
prendre
en
compte
les
différences
culturelles,
face
à
des
familles
qui
-
quelques
précautions
qu’on
puisse
prendre
-
se
sentent
tôt
ou
tard
suspectées,
voire
accu-
sées.
Les
différences
(techniques,
psychologiques)
de
point
de
vue
ne
sont
donc
pas
les
seuls
justificatifs
de
la
nécessité
d’une
équipe
multidisciplinaire
:
dans
ce
débat
douloureux,
émotionnellement
fort,
les
impressions
personnelles
et
les
convictions
intimes,
mais
aussi
les
incertitudes,
doivent
être
discutées
et
confrontées.
Dans
la
quasi-totalité
des
cas,
la
vérité
n’est
approchée
que
pas
à
pas.
Il
est
exceptionnel
que
le
traumatisme
causal
soit
unique
et
parfaitement
déter-
minable.
L’enfant
martyr
de
parents
bourreaux,
dans
cette
tranche
d’âge,
nous
ne
l’avons
jamais
rencontré.
Tout
est
plus
insidieux,
subtil
et
nuancé.
 6
6
 7
7
1
/
7
100%