Le traitement pharmacologique des dyslipidémies mis en

Revues générales
1
Résumé : Les textes des recommandations de pratique clinique [1] sur le traitement des dyslipidémies étant
largement diffusés et disponibles gratuitement sur Internet, tout médecin peut y avoir accès. Paraphraser un
de ces textes en expliquant certains de ses fondements, en l’actualisant et en y apportant quelques touches
personnelles n’a donc vraiment pas un grand intérêt.
Il nous semble en effet plus utile d’avoir d’autres perspectives en essayant de comprendre ce que pourraient
ou devraient être les éléments pour une pratique clinique dont l’objectif est la correction du risque
cardiovasculaire en agissant avec des médicaments dont un des effets s’exerce sur le métabolisme des lipides.
Cette approche constitue le propos de cet article.
➞ F. DIEVART
Clinique Villette,
DUNKERQUE.
Le traitement pharmacologique
des dyslipidémies mis en perspectives
au-delà des recommandations
[
De quelques bases
du raisonnement
Le concept recouvert par le terme “dys-
lipidémie” est apparu lorsqu’a été mis
en évidence un lien entre les valeurs
plasmatiques et/ou le métabolisme de
certains paramètres lipidiques et le déve-
loppement de la maladie athéromateuse
avec son risque associé d’événement cli-
nique majeur. Les supports de ce concept
proviennent principalement de deux
voies de recherche : fondamentale et
clinique ou plutôt épidémiologique. La
première a permis de comprendre par
quels mécanismes les lipides plasma-
tiques sont impliqués dans une maladie
de certaines artères dénommée athé-
rothrombose et la seconde a mis en évi-
dence des corrélations entre des valeurs
mesurables de certains lipides plasma-
tiques et le risque de survenue d’un acci-
dent ischémique coronaire.
Le terme de dyslipidémie pourrait être
ainsi défini par des modalités du méta-
bolisme des lipides et/ou des valeurs
des paramètres lipidiques plasmatiques
associées à une augmentation relative
du risque de maladie athérothrombo-
tique. Cette définition est une défini-
tion conceptuelle, utile mais de peu de
portée pratique. Elle nécessite d’être
complétée par une définition opération-
nelle consistant à proposer des critères
permettant de juger si, face à un patient
donné, un médecin est en présence ou
non d’une dyslipidémie : ces critères
peuvent être un profil génétique, une
valeur attribuée à la mesure de l’acti-
vité de certaines enzymes, ou à celle de
paramètres lipidiques plasmatiques…
Un patient dont le LDL-cholestérol est
au-dessus d’une certaine valeur absolue,
arbitrairement choisie, sera ainsi consi-
déré comme à risque et donc comme
ayant une dyslipidémie. Cette valeur
ne peut être qu’arbitraire puisque le
lien entre LDL-cholestérol et risque
coronaire est linéaire et sans seuil [2]. Il
en est de même pour la valeur du HDL-
cholestérol.

Revues générales
2
giques, des extrapolations des données
validées de la science et ces mêmes don-
nées de la science. Plus encore, l’étude
de la psychologie sociale permet de
comprendre que les mécanismes psy-
chologiques sous-jacents au travail en
groupe peuvent induire des jugements
non adaptés à une situation donnée [10].
Ainsi, par exemple, si les recommanda-
tions des sociétés expertes pour la prise
en charge des dyslipidémies proposent
toutes des cibles de LDL-cholestérol
à atteindre en fonction d’un niveau
de risque coronaire, aucune étude n’a
validé la valeur de ces cibles dans les
situations ciblées dans les recomman-
dations. En effet, par exemple, si l’étude
TNT [11] valide le bénéfice clinique de
l’abaissement du LDL en dessous d’1 g/L
chez des coronariens, elle n’a inclus que
des patients dont le LDL initial était bas.
Aucune étude n’a pris en compte des
coronariens dont le LDL est très élevé
et dont l’objectif aurait été de l’abaisser
en dessous d’1 g/L. L’étude TNT a sim-
plement démontré que lorsque le LDL
est déjà bas, il est bénéfique de l’abais-
ser encore plus avec une statine chez un
coronarien stable. La stratégie proposant
des cibles absolues de LDL-cholestérol
ne repose donc pas sur une démonstra-
tion scientifique mais sur une construc-
tion théorique, un modèle opérationnel
qui n’est qu’une extrapolation à partir
d’une des analyses possibles des don-
nées de la science.
De même, la stratégie proposée (ici celle
d’une cible absolue de LDL) peut ne pas
être adaptée au problème qu’elle est cen-
sée résoudre puisqu’elle comporte une
double limite :
– celle de ne pas traiter un patient qui
serait à risque coronaire élevé, parce
que son LDL est en dessous de la cible
arbitrairement proposée pour ce niveau
de risque [12]. Les données validées
de la science, et notamment une étude
comme JUPITER [13], en démontrant
qu’un abaissement du LDL nettement
en dessous d’1 g/L peut être bénéfique
bas, n’apportent pas de bénéfice cli-
nique (cas du bézafibrate dans l’étude
BIP [4]. Plus encore, il a pu être montré
qu’un traitement qui augmente le HDL-
cholestérol de 72 % augmente aussi
significativement la mortalité totale et la
mortalité cardiovasculaire (cas du torce-
trapib dans l’étude ILLUMINATE, [5] ou
qu’un traitement qui augmente le HDL
de façon significative augmente tout
aussi significativement (et en moyenne
de 32 %) le risque d’accident vasculaire
cérébral (cas du traitement hormonal de
la ménopause [6]. Concernant le torce-
trapib, qu’en aurait-il été s’il avait été
commercialisé en fonction de ses effets
lipidiques et avant d’avoir été évalué
dans un essai thérapeutique contrôlé ?
Aurait-on su qu’il était nocif ? Ce deux-
ième mode de jugement exige donc que
la preuve du bénéfice clinique d’un
traitement soit apportée par un essai
thérapeutique contrôlé suffisamment
puissant et adapté.
[ Les choix du médecin
Pour prendre une décision, le médecin est
donc confronté à trois types d’arguments :
– ceux reposant sur un rationnel logique
mais sans évaluation clinique pertinente,
– ceux issus exclusivement des essais
thérapeutiques contrôlés,
– ceux provenant des recommandations
de pratique clinique.
S’il est admis que les recommandations
des sociétés expertes doivent être les
critères prioritaires pour établir une
démarche thérapeutique, force est de
reconnaître qu’elles peuvent être criti-
quées, notamment lorsqu’elles préten-
dent faire la synthèse des données vali-
dées de la science, et ce par la synthèse
des essais thérapeutiques contrôlés.
Nombre de publications récentes [7-9]
ont démontré que plusieurs recomman-
dations proposent des stratégies qui n’ont
pas un niveau de preuve suffisant et font
donc un amalgame entre des convictions
d’experts, des données physiopatholo-
Avoir reconnu qu’il existe une associa-
tion entre le métabolisme des lipides
et le risque de maladie athérothrom-
botique a fourni des cibles à des théra-
peutiques pouvant modifier ce méta-
bolisme, action parfois reflétée par les
modifications des valeurs mesurables
de paramètres lipidiques. La valeur des
traitements proposés dans les dyslipidé-
mies peut être jugée de deux façons : par
l’effet qu’ils exercent sur les paramètres
lipidiques et par l’effet clinique qu’ils
procurent. Dans ce texte, plutôt que le
terme “hypolipémiant”, nous utiliserons
l’expression “médicaments dont un des
effets s’exerce sur le métabolisme des
lipides”, il est en effet illusoire de penser
qu’un médicament n’est qu’un hypoli-
pémiant et qu’il n’agit pas sur d’autres
cibles que les paramètres lipidiques,
cibles qui pourraient être en cause dans
d’éventuels effets indésirables.
De ces modes d’appréhension sont issus
deux modes extrêmes de raisonnement
et de nombreux raisonnements associent
ces extrêmes à des degrés divers :
– à un extrême, le mode de raisonnement
est surtout physiopathologique : il envi-
sage le lien entre les paramètres lipidiques
et les effets des médicaments sur la nature
de ce lien et tend à proposer des traite-
ments à partir d’un rationnel physiopa-
thologique. Prenons un exemple : le méca-
nisme par lequel le HDL exerce un effet
de prévention de l’athérome, bien qu’ex-
trêmement complexe, est supposé connu,
il existe un lien épidémiologique fort et
inversement proportionnel entre le HDL
et le risque coronaire, et tel traitement per-
met d’augmenter le HDL-cholestérol ; la
conclusion s’impose, il faut donc le pro-
poser aux patients jugés à risque et ayant
un HDL-cholestérol bas [3],
– à l’autre extrême, le jugement postule
qu’un rationnel physiopathologique, s’il
est nécessaire n’est pas suffisant. Ainsi,
il a été maintes fois démontré que des
traitements augmentant significative-
ment le HDL-cholestérol, y compris chez
des patients à haut risque (prévention
secondaire) et ayant un HDL-cholestérol

3
multiples essais thérapeutiques contrô-
lés et méta-analyses [15, 16] que les sta-
tines permettent de diminuer le risque
d’événements coronaires majeurs, d’ac-
cident vasculaire cérébral et de décès
vasculaire quelles que soient les carac-
téristiques démographiques (âge et sexe),
cliniques (prévention primaire et secon-
daire, présence ou non d’un diabète…) et
lipidiques (quelles que soient les valeurs
de LDL, de HDL et de triglycérides) des
sujets traités. Le bénéfice clinique est
linéairement corrélé à la réduction du
LDL obtenue sous traitement.
Cette démonstration a des implications
particulières et quelques limites :
>>> La première implication est que le
concept de dyslipidémie devrait être
remplacé par celui de risque : quelle
que soit la valeur des paramètres lipi-
diques, dès lors qu’un patient à un
risque d’événement coronarien non
nul, proposer une statine (dont un
des effets principaux est de diminuer
le LDL-cholestérol) diminue le risque
d’événement coronaire proportion-
nellement à la dose utilisée, et donc à
l’abaissement du LDL obtenu, et cela
quelle que soit la valeur initiale du
LDL-cholestérol. Il pourrait donc être
possible de se passer d’un dosage des
lipides plasmatiques pour proposer une
statine et diminuer le risque [12] : il y a
une logique à penser, comme le font cer-
tains médecins, que c’est l’évaluation
du niveau de risque, et non la valeur
des paramètres lipidiques, qui devrait
servir d’inducteur de prescription.
>>> Par ailleurs, comme le suggèrent
les recommandations, plus le niveau de
risque est élevé, plus la valeur de LDL à
atteindre doit être basse, et donc, plus la
dose de statines devrait être élevée afin de
diminuer le risque au maximum possible.
Quelles sont les limites d’un tel raison-
nement ? Il y a en plusieurs, qui n’en
modifient toutefois pas le principe fon-
damental :
gée”. Plus encore, il est utile que le risque
éventuel de ce traitement soit connu, que
le patient en soit averti, et que la balance
bénéfice-risque de ce traitement lui soit
exposée. Comment peut être connue la
balance bénéfice-risque d’un traitement
s’il n’a pas été déjà évalué de façon fiable
chez des humains ? Le patient à qui est
proposé un traitement non évalué correc-
tement subit en effet plusieurs préjudices :
le premier est la tromperie parce qu’il fait
confiance et pense que le traitement pres-
crit a fait la pleine preuve de son effica-
cité alors que ce n’est pas vrai, et il subit
aussi deux risques, celui de prendre un
traitement sans bénéfice réel et celui de
prendre un traitement faisant courir un
risque non connu. Alors que les patients
enrôlés dans les essais thérapeutiques se
désignent parfois comme cobayes, ceux
à qui sont prescrits des traitements non
éprouvés sont à la fois des cobayes, mais
des cobayes inutiles puisqu’ils ne font
pas progresser la science. En revanche,
un patient inclus dans un essai clinique
contribue à faire progresser la science en
acceptant de participer à l’évaluation d’un
traitement pharmacologique dont on ne
sait a priori s’il peut être utile, voire s’il
est délétère.
Dès lors, ne devraient être utilisés que
les traitements ayant été évalués dans
des essais thérapeutiques contrôlés puis-
sants et adaptés. Il ne s’agit donc plus de
raisonner en termes de cibles thérapeu-
tiques, mais aussi en termes de degré de
connaissance des molécules disponibles.
Dans ce mode de raisonnement, concer-
nant les dyslipidémies, le poids des
preuves est en faveur d’une utilisation
prioritaire, voire quasi exclusive des sta-
tines et en priorité de celles les mieux
évaluées.
[
Grandeur et limites
des statines
Depuis 1994, date de la publication de
l’étude 4S [14], il a été démontré par de
cliniquement, en prévention primaire et
hors diabète, chez des patients dont le
niveau de risque est qualifié d’intermé-
diaire, démontrent qu’une stratégie repo-
sant sur une cible absolue constitue une
perte de chances pour certains patients,
– celle de proposer des stratégies thé-
rapeutiques non validées, sans effet
reconnu, ou parfois à risque (associa-
tions de statines avec d’autres molé-
cules) parce que la cible thérapeutique
proposée n’a pu être atteinte avec l’uti-
lisation des stratégies validées (statines
à posologie élevée). La stratégie d’une
cible absolue qui ne pourrait être atteinte
qu’en utilisant des traitements non
éprouvés constitue donc aussi une perte
de chances pour certains patients en leur
faisant courir un risque non connu pour
un bénéfice non connu.
[
Quel autre mode d’analyse
des données de la science ?
Tout opérationnelles et consensuelles
qu’elles soient, les recommandations
sont donc faillibles. Que doit alors faire
le médecin ? Il peut faire reposer sa pra-
tique sur quelques principes :
>>> Un premier principe est le regard
critique (les paragraphes précédents en
exposent quelques raisons) qui suppose
de ne pas déléguer son raisonnement à
des intermédiaires. Cela nécessite une
approche scientifique et un travail de lec-
ture et d’analyse appuyé sur une méthode.
>>> Un deuxième principe est résumé par
l’aphorisme primum, non nocere dont la
traduction est “avant tout, ne pas causer
de préjudice”, mais qui pourrait tout aussi
bien être traduit par “savoir tempérer l’en-
thousiasme thérapeutique”. Un principe
de base est ainsi de juger que proposer un
traitement pharmacologique à un sujet
qui ne se plaint de rien pour corriger un
risque individuel hypothétique de sur-
venue d’un événement impose que la
démonstration du bénéfice soit établie
et non pas seulement “fortement envisa-

Revues générales
4
coronariens, sans effet sur la mortalité
totale et avec une tendance à l’augmen-
tation des décès non coronariens),
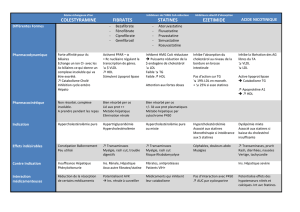
– l’acide nicotinique [18] apporte un
bénéfice modeste dans un essai théra-
peutique contrôlé et est en évaluation
dans deux essais thérapeutiques contrô-
lés, l’étude AIM HIGH et l’étude HPS 2,
– l’ézétimibe est en évaluation dans un
grand essai, l’étude IMPROVE IT [19].
Les essais jusqu’ici disponibles n’ont pas
permis de juger si cette molécule a un effet
clinique spécifique indépendant et additif
à celui d’utne statine, à laquelle elle a été
associée dans les études SEAS et SHARP.
Les alternatives aux statines validées
sont donc constituées, en termes de
niveau de preuve acceptable et sans
que les risques spécifiques de ces traite-
ments soient parfaitement connus, par le
gemfibrozil, la cholestyramine et l’acide
nicotinique.
[ Se posent alors trois questions
>>> La première est : ces traitements
doivent ou peuvent-ils être utilisés
en complément des statines pour
compléter leur action lipidique et/ou
diminuer plus encore le risque cardio-
vasculaire ? Le rapport bénéfice-risque
de ces traitements, lors d’une associa-
tion aux statines, n’est pas connu et,
en toute logique, ils ne devraient pas
être utilisés en association aux statines
pour atteindre des cibles lipidiques qui
en l’état actuel des connaissances sont
des objectifs arbitraires. Dans l’étude
ACCORD lipides [20], l’association
d’un fibrate et d’une statine n’apporte
aucun bénéfice clinique et la seule ana-
lyse en sous-groupe significative montre
un effet délétère de cette association
chez les femmes. La seule limite à ce
raisonnement est le résultat de l’étude
SHARP ayant montré qu’une association
d’une statine et d’ézétimibe apporte un
bénéfice clinique chez des insuffisants
rénaux. Dans cette étude, il n’est pas pos-
sible de juger ce qu’aurait été l’effet de
vasculaire, et si certains envisagent
des prescriptions dès le plus jeune âge
(comme en témoigne la question parfois
débattue aux Etats-Unis : “Faut-il mettre
une statine dans le biberon des bébés ?”)
et pour la vie entière, l’utilisation de ce
traitement doit être raisonnée en fonc-
tion d’un niveau de risque faisant que le
bénéfice en dépasse le risque.
[ Les alternatives
Quel autre traitement proposer pour
réduire le risque cardiovasculaire
lorsque les statines ne peuvent être uti-
lisées, c’est-à-dire lorsqu’elles sont mal
tolérées ou lorsque le patient est dans
une situation clinique correspondant aux
limites connues du bénéfice des statines ?
Le raisonnement peut porter sur deux
appréciations différentes : celle de la
situation clinique et celle de la valeur
des autres traitements. Concernant les
autres traitements, leur degré d’éva-
luation est soit nul, soit faible, soit
indique un bénéfice clinique modeste
contribuant à en faire des traitements
de seconde intention. Ainsi, parmi les
molécules ou classes thérapeutiques dis-
ponibles, il peut être conclu que :
– les fibrates [17] apportent un faible
bénéfice clinique (réduction du risque
d’événement coronaire de 13 %) et la
classe est hétérogène quant aux résul-
tats qu’elle apporte. Il semble que le clo-
fibrate augmente le risque de mortalité
totale et d’infarctus fatal (méta-analyses
et étude WHO), que le bézafibrate et le
fénofibrate n’ont pas d’effets cliniques
(respectivement études BIP et FIELD) et
que le gemfibrozil apporte un bénéfice
clinique modique mais réel à posologie
élevée (études HHS et VA-HIT). Il semble
aussi que les fibrates augmentent le
risque de phlébite et peut-être de décès
non vasculaires,
– la cholestyramine [18] apporte un
bénéfice modeste, et ce dans un essai
thérapeutique contrôlé, l’étude Lipid
Research Clinic (diminution des décès
>>> Une première limite est surpre-
nante : dans une des situations cliniques
où le risque cardiovasculaire est le plus
élevé, l’insuffisance rénale terminale
dialysée, un traitement par statine n’ap-
porte aucun bénéfice clinique. C’est
ce qui a été démontré par les études
AURORA et 4D. Et donc, l’extrapola-
tion faisant qu’un abaissement du LDL
doit être proposé surtout aux sujets à
très haut risque justifie des fondements
plus solides que la simple extrapolation
des données obtenues chez des sujets de
risque intermédiaire à élevé.
>>> Une deuxième limite est que, dans
plusieurs situations cliniques, il manque
des preuves pour affirmer que les sta-
tines apportent un bénéfice clinique :
c’est le cas, par exemple, des sujets très
âgés (notamment au-delà de 85 ans),
c’est le cas des niveaux très bas de LDL
(notamment en dessous de 0,40 g/L) et
des niveaux très élevés de triglycérides
(probablement au-delà de 4 g/L), c’est
aussi le cas des patients ayant des anté-
cédents d’hémorragie cérébrale.
>>> Une troisième limite est une inter-
rogation : où s’arrêter dans l’augmen-
tation de posologie ? Si le risque dimi-
nue proportionnellement à la dose et à
l’abaissement du LDL, pourquoi, chez
des patients de risque intermédiaire ou
faible, ne pas proposer de fortes doses
de statines dès lors qu’elles sont bien
tolérées, jusque dans la limite d’obten-
tion de LDL vers 0,40 g/L, par exemple,
ou jusque dans la limite des posologies
autorisées des statines disponibles ?
>>> Enfin, une dernière limite est que le
traitement n’est pas sans risque (notam-
ment d’effets musculaires, hépatiques
et/ou d’interactions médicamenteuses)
et ne peut donc être proposé à tous les
patients ayant un risque non nul d’évé-
nement athérothrombotique.
Ainsi, si les données validées de la
science font des statines un traitement
majeur de réduction du risque cardio-

5
[
Que faire en cas
d’hypertriglycéridémie
isolée ?
Il n’y a aucune preuve directe et puis-
sante qu’une action pharmacologique
sur la triglycéridémie apporte un béné-
fice clinique, notamment cardiovascu-
laire, et ne comporte pas de risque. Le
traitement de l’hypertriglycéridémie,
si des arguments convainquent qu’elle
peut être spécifiquement délétère, pour-
rait donc être essentiellement diététique,
jusqu’à ce qu’il existe une preuve d’un
rapport bénéfice-risque favorable à
l’utilisation d’un traitement pharma-
cologique dans l’hypertriglycéridémie
isolée.
Et le cas associant HDL bas et triglycé-
rides élevés ? Là encore, il n’y a aucune
preuve directe, puissante et concordante
qu’une action pharmacologique sur ce
profil lipidique apporte un bénéfice cli-
nique, notamment cardiovasculaire, et
qu’une telle action ne comporte pas de
risque. Plusieurs arguments indirects
indiquent que les fibrates pourraient
être bénéfiques dans cette situation
lipidique, mais aucune preuve suffi-
sante d’un bénéfice n’existe. Dans cette
situation, si le raisonnement incite à pro-
poser un fibrate, les données des essais
cliniques sont plus en faveur du bénéfice
apporté par une statine.
[ Perspectives
Il existe encore de nombreuses incon-
nues concernant la valeur et le rapport
bénéfice-risque de divers traitements
pharmacologiques agissant entre autres
sur les paramètres lipidiques, et sur les
modalités de réduction du risque car-
diovasculaire chez des patients ayant
des profils lipidiques reconnus comme
exposant à un risque cardiovasculaire
augmenté.
Certaines de ces inconnues seront levées
dans les proches années :
ayant un HDL-cholestérol bas, l’étude
AFCaps/TexCaps [21] conduite avec la
lovastatine, l’étude BIP conduite avec le
bézafibrate et l’étude VA-HIT conduite
avec le gemfibrozil.
L’étude AFCaps/TexCaps a démontré que
l’abaissement du LDL avec une statine
permet de diminuer le risque d’événe-
ments cardiovasculaires chez des patients
ayant un HDL-cholestérol bas en préven-
tion primaire. L’étude VA-HIT a démontré
que le gemfibrozil, en prévention secon-
daire et alors qu’il n’a eu aucun effet sur
le LDL-cholestérol, permet de diminuer
le risque d’événements cardiovasculaires
de patients ayant un HDL-cholestérol bas.
Dans cette étude, le HDL a été augmenté de
6 % sous gemfibrozil. En revanche, dans
l’étude BIP, conduite elle aussi en pré-
vention secondaire, et alors que le bézafi-
brate avait augmenté le HDL-cholestérol
de 18 % et diminué significativement le
fibrinogène plasmatique, il n’y a eu aucun
bénéfice clinique du traitement.
Plus encore, une méta-analyse parue
en 2009 a montré qu’il n’y avait aucune
corrélation entre l’élévation du HDL-
cholestérol par un traitement pharma-
cologique et la diminution du risque
cardiovasculaire. De plus, l’étude
ILLUMINATE a montré qu’un inhibiteur
de la CETP (le torcetrapib) peut augmen-
ter significativement la mortalité totale et
la mortalité cardiovasculaire alors qu’il
augmente le HDL-cholestérol de 72 %.
Il n’y a donc aucune preuve que l’aug-
mentation pharmacologique du HDL-
cholestérol apporte un bénéfice clinique.
En cas de HDL-cholestérol bas, l’étude
AFCaps/TexCaps incite à proposer en
première intention une statine et cette
attitude est la plus logique car la dimi-
nution du LDL-cholestérol par une sta-
tine apporte un bénéfice clinique, quelle
que soit la valeur du HDL-cholestérol.
En cas d’intolérance aux statines, l’étude
VA-HIT incite à utiliser en seconde
intention le gemfibrozil.
l’ézétimibe et/ou de la statine indépen-
damment de l’autre molécule, le groupe
contrôle ayant reçu un placebo. Cette
étude, dans cette situation clinique,
incite donc à proposer l’association
d’une statine et d’ézétimibe.
>>> La deuxième question pourrait être
formulée de la manière suivante : ces
traitements doivent ou peuvent-ils être
utilisés à la place des statines lorsque
celles-ci sont mal tolérées et doivent être
arrêtées chez des sujets à risque cardio-
vasculaire ? Les trois molécules citées
comme alternatives aux statines ont été
évaluées dans des essais thérapeutiques
anciens ayant montré un bénéfice clinique
qui,même modique, est réel sur le plan
coronaire (mais parfois contrebalancé par
des effets adverses non expliqués dans le
cas de la cholestyramine). Ces essais per-
mettent de proposer l’emploi de ces traite-
ments en cas d’intolérance aux statines et
de risque cardiovasculaire élevé.
>>> La troisième question est : ces trai-
tements doivent ou peuvent-ils être
utilisés à la place des statines dans les
situations cliniques qui constituent des
limites à l’emploi des statines ? Comme
il est écrit précédemment dans cet article,
il y a peu de situations cliniques qui
constituent des limites d’emploi des sta-
tines. Deux principales permettent d’ob-
tenir une réponse simple : le sujet très âgé
et le sujet à très haut risque cardiovascu-
laire parce qu’insuffisant rénal dialysé. Le
niveau de preuve de traitements agissant
sur les lipides et autres que les statines
dans ces deux situations cliniques est nul,
et aucune molécule n’a de rapport béné-
fice-risque suffisamment évalué pour être
proposé chez ce type de patients. L’autre
situation est plus discutée : il s’agit d’un
profil lipidique avec HDL-cholestérol bas
et/ou triglycéridémie élevée.
[ Que faire en cas de HDL bas ?
Trois essais thérapeutiques ont été spé-
cifiquement conduits chez des patients
 6
6
1
/
6
100%
![Bon à savoir : [ téléchargez le pdf ]](http://s1.studylibfr.com/store/data/003771706_1-93023e0d2df6ea55d4819d1e0d17f192-300x300.png)