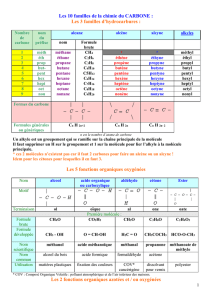
Documents de Physique-Chimie – M. MORIN 1 Thème : Lois et

Documents de Physique-Chimie – M. MORIN
1
Thème : Lois et modèles
Partie : Structure et transformation de la matière
Cours 25 : Transformations en Chimie organique
Partie B : Mécanismes réactionnels - Les grandes catégories de réactions en Chimie organique
I. Avant- propos sur la représentation de Lewis :
La représentation de Lewis consiste a représenter les électrons de la couche externe par des points lorsqu’ils sont
célibataires ou par un trait lorsqu’ils sont sous la forme d’un doublet.
Exemples de représentation de Lewis d’atomes :
Exemples de représentation de Lewis de molécules :
L‘ion hydroxyde est formé à partir d’une
molécule d’eau.
Un proton quitte la molécule d’eau.
Il laisse sur l’oxygène son électron.
L’oxygène possède donc un excès d’un électron
qui est symbolisé par un signe moins.
L’ion oxonium est formé à partir
d’une molécule d’eau.
Un électron d’un des doublets
de l’oxygène et l’électron de
l’hydrogène ont à servis à créer
une liaison covalente entre eux.
Il manque donc maintenant un électron
à l’oxygène. Ce défaut d’un électron est
symbolisé par un signe plus.

Documents de Physique-Chimie – M. MORIN
2
II. Le mécanisme réactionnel.
Avant de détailler les grandes catégories de réactions en Chimie organique, il faut se poser deux
questions :
Pourquoi des molécules réagissent-elles entre-elles ?
Comment modéliser le mécanisme réactionnel ?
1. Pourquoi des molécules réagissent-elles entre-elles ?
1.1. Observons la molécule de 2-chlorométhylpropane.
Posons-nous quelques questions ?
- Quel atome sera chargé négativement ? positivement ? sachant que l’électronégativité du chlore est
égale à 3,2 et celle de l’atome de carbone 2,5.
- La molécule est-elle polaire ?
- Quelle liaison est ainsi fragilisée et peut potentiellement se rompre ?
Les réponses :
L’atome de chlore étant électronégatif, il portera une charge partielle négative.
L’atome de carbone lié à ce chlore sera ainsi porteur de charges partielles positives.
Le barycentre des charges négatives n’est pas confondu avec le barycentre des charges positives, la
molécule est donc polaire.
La liaison fragilisée est la liaison C-Cl polarisée.
1.2. Une molécule d’eau serait-elle susceptible de réagir avec la molécule de 2-
chlorométhylpropane ?
La molécule d’eau est également une molécule polaire
On distingue sur ces deux molécules :
o un site donneur d’électrons (qui cherche des atomes chargés positivement). Il sera négatif.
o un site accepteur d’électrons (qui aime les atomes chargés négativement). Il sera positif.
Situer sur chaque molécule le site donneur et le site accepteur d’électrons.

Documents de Physique-Chimie – M. MORIN
3
Réponse :
C’est le site accepteur C’est le chlore qui polarise la liaison C-H
C’est le site donneur
2. Modélisation du mécanisme réactionnel.
Une liaison chimique peut être créée entre un site donneur d’une molécule et un site accepteur
d’une autre molécule.
Une liaison chimique étant l’appariement de deux électrons, un doublet est nécessaire pour la
formation d’une liaison covalente.
Il y aura interaction entre un site donneur et un site accepteur de doublets électronique.
Par convention on représente le mouvement d’un doublet d’électrons à l’aide d’une flèche courbe
lors d’une étape d’un mécanisme réactionnel.
La flèche part d’un doublet et se dirige vers le site accepteur de doublet d’électrons
Une étape du mécanisme réactionnel s’écrit :
Pour aller plus loin dans ce mécanisme, on écrit :
+ Cl-

Documents de Physique-Chimie – M. MORIN
4
+ H3O+
Le bilan de cette réaction a donc consisté à substituer un chlore par groupement hydroxyle –OH.
III. Les grandes catégories de réactions en chimie organique : substitution, addition, élimination.
1. Comment reconnaitre la catégorie de réactions à partir de l’examen de la nature des réactifs et
des produits.
1.1. Cas de l’existence d’une liaison polarisée C- X (C-Cl, C-Br ou C-I)
Les dérivés monohalogénés ne possèdent que des liaisons simples.
C - Cl
C - Br
C - I
Electronégativité de
l’halogène
3,2
3,0
2,7
+ -
La liaison C - X est déjà polarisée, mais elle peut se polariser encore plus sous l’action d’un
champ électrique extérieur créé par un réactif possédant un site donneur d’électrons, une base
(HO-), un solvant (H2O).
Deux catégories de réactions peuvent être pressenties
Les substitutions Les éliminations
R – X + Y- R - Y + X- Y- + = + HY + X-
CH3-Cl + HO- CH3-OH + Cl- C2H5O- Na++ + C2H5OH + Br-
Ethanolate de sodium

Documents de Physique-Chimie – M. MORIN
5
Questions :
1. Donner la représentation de Lewis de l’ion hydroxyde et l’ion éthanolate.
2. Dans les deux exemples décrits précédemment, indiquer quels sont les sites donneurs et accepteurs
d’électrons.
3. Représenter par une flèche courbe la première étape du mécanisme réactionnel de chacune de ces
réactions.
Réponses :
1. Représentation de Lewis.
L’oxygène a pour représentation de Lewis
L’hydrogène a pour représentation de Lewis
L’ion hydroxyde qui est une molécule d’eau ayant perdu un proton a pour représentation
de Lewis
De même l’ion éthanolate qui est l’éthanol ayant perdu un proton a pour représentation de Lewis
2. Sites donneur (nucléophile) et accepteur (électrophile) d’électrons.
Substitution
Site accepteur d’électrons
Site donneur d’électrons
Elimination
Site donneur d’électrons
3. Substitution Elimination
 6
6
1
/
6
100%