Chimie Organique : Familles de Composés du Carbone

1
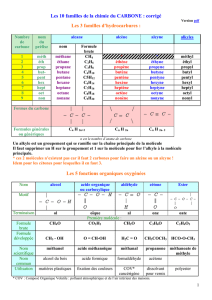
Les 10 familles de la chimie du CARBONE :
Les 3 familles d’hydrocarbures :
n est le nombre d’atome de carbone
Un alkyle est un groupement qui se ramifie sur la chaîne principale de la molécule
Il faut supprimer un H sur le groupement et 1 sur la molécule pour lier l’alkyle à la molécule
principale.
* ces 2 molécules n’existent pas car il faut 2 carbones pour faire un alcène ou un alcyne !
Idem pour les cétones pour lesquelles il en faut 3.
Les 5 fonctions organiques oxygénées
* COV : Composé Organique Volatile : polluant atmosphérique et de l’air intérieur des maisons.
Les 2 fonctions organiques azotées et / ou oxygénées
Nombre
de
carbone
nom
du
préfixe
alcane
alcène
alcyne
alkyles
nom
Formule
brute
1
méth
méthane
CH4
*
*
méthyl
2
éth
éthane
C2H6
éthène
éthyne
éthyl
3
prop
propane
C3H8
propène
propyne
propyl
4
but-
butane
C4H10
butène
butyne
butyl
5
pent
pentane
C5H12
pentène
pentyne
pentyl
6
hex
hexane
C6H14
hexène
hexyne
hexyl
7
hept
heptane
C7H16
heptène
heptyne
heptyl
8
oct
octane
C8H18
octène
octyne
octyl
9
non
nonane
C9H20
nonène
nonyne
nonyl
Formes du carbone
Formules générales
ou génériques
Cn H 2n+2
Cn H 2n
Cn H 2n- 2
Nom
alcool
acide organique
ou carboxylique
aldéhyde
cétone
Ester
Motif
Terminaison
ol
oïque
al
one
oate
Première molécule :
Formule
brute
CH4O
CO2H2
CH2O
C3H6O
C2H4O2
Formule
développée
CH3 - OH
O = CH-OH
H2C = O
CH3COCH3
HCO-O-CH3
Nom
scientifique
méthanol
acide méthanoïque
méthanal
propanone
méthanoate de
méthyle
Nom
commun
alcool du bois
acide formique
formaldéhyde
acétone
Utilisation
matières plastiques
fixation des couleurs
COV*
cancérigène
dissolvant
pour vernis
polyester

2
Valence des atomes
* c’est le complément à 8 par valeurs inférieures de la ligne ** pour 1 à 3 électrons et par valeurs
supérieures pour 5, 6 et 7. Dans ce dernier cas, la somme des lignes * et ** = 8. Pour 4 c’est 4 électrons
célibataires : cas de la tétravalence du carbone.
Une liaison covalente est la mise en commun de 2 électrons par 2 atomes : elle est représentée par un trait.
Elle peut être double (2 traits donc 4 électrons) ou triple (3 traits donc 6 électrons).
Nom
Amine
Amide
Motif
- NH2
Terminaison
amine
Première molécule :
Formule brute
CNH5
HCONH2
Formule développée
CH3 – NH2
Nom scientifique
méthanamine
méthanamide
Nom commun
méthyl amine
formamide
Utilisation
Odeur de poisson
Polyamide
Atome
Carbone
Azote
oxygène
hydrogène
Chlore
Symbole
C
N
O
H
Cl
Nombre de masse : A
12
14
16
2
35
Numéro atomique : Z
6
7
8
1
17
Nombre d’électrons sur la
dernière couche **
4
5
6
1
7
Nombre d’électrons célibataires*
4
3
2
1
1
Valence
4
3
2
1
1
Nombre de liaisons covalentes
4
3
2
1
1
1
/
2
100%