FC : C3 - Fiche 2 : Formation des molécules = > référence : chapitre

FC : C3 - Fiche 2 : Formation des molécules
= > référence : chapitre 6, §1, page 99-100
1) Rappel d’une constatation : stabilité chimique des gaz rares (colonne 18)
Ce sont les électrons de la couche de valence (en rouge ci-dessous) qui sont mis en jeu lors des
transformations chimiques.
Justement les atomes de la colonne 18 sont (quasiment) inertes chimiquement ! Cette stabilité
découle de leur structure électronique en duet ou en octet :
He (Z = 2) : (K)2 règle du _____________
Ne (Z = 10) : (K)2 (L)8
Ar (Z = 18) : (K)2 (L)8 (M)8 règle de _____________
Kr (Z = 36) : (K)2 (L)8 (M)18 (N)8
2) Règles de l’octet (et du duet)
Les atomes tendent à obtenir la structure électronique du gaz rare le plus _____________ dans
la classification :
- (vue en seconde) Soit en ______________ un ou plusieurs électrons comme ceux des
colonnes 17 (halogènes) et 16 : ils forment alors des anions. Exemples : Cl- ou O2-
- (vue en seconde) Soit en ____________ un ou plusieurs électrons comme ceux des colonnes
1 (alcalins) et 2 (alcalino-terreux) : ils forment alors des cations. Exemples : Na+ ou Ca2+
- Soit, comme ceux des colonnes 14, 15 et 16 notamment, en se liant avec d’autres atomes par
l’intermédiaire de liaisons covalentes : il se crée alors une ____________________.
3) Qu’est-ce qu’une liaison covalente ?
Une liaison chimique covalente consiste en la __________________________________ de
deux électrons entre deux atomes qui apporte chacun un électron. Il se forme alors ou doublet
_________ (par opposition au doublet non-liant, localisé sur un atome et constitué d’électrons
non engagés dans la formation de la liaison).
NB : Bien sûr les liaisons covalentes peuvent être multiples (doubles ou simples).
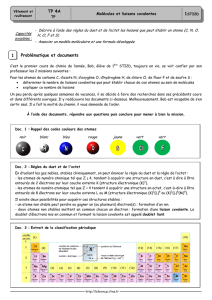
4) Représentation (ou formule) de Lewis
La représentation de Lewis d’une molécule représente les atomes qui la
constituent et leurs électrons de valence regroupés en doublets qui sont
représentés par un tiret.
Méthode : Elle se déduit par la méthode présentée dans le livre page 100 ou
par « construction » à partir des représentations atomiques de Lewis
(tableau ci-contre).
Vérification du respect de la règle de l’octet :
Atome
H
C
N
O
Numéro atomique
Structure électronique
Nombres d’électrons de valence
Atome
Valence
1
4
3
2
H
C
N
1
/
1
100%