Le pembrolizumab, un produit de Merck, améliore de façon

Communiqué de presse
_____________________________________________________________________________________
POUR DIFFUSION IMMÉDIATE
Relations avec les
médias :
Annick Robinson
438-837-2550
Relations avec les
investisseurs :
Teri Loxam
908-740-1986
Le pembrolizumab, un produit de Merck, améliore de façon significative la survie
globale, comparativement à la chimiothérapie, chez les patients atteints d’un
cancer de la vessie (tumeur urothéliale) de stade avancé ayant déjà été traités
Données de l’étude de phase III KEYNOTE-045 présentées pour la première fois à
l’occasion du 31e congrès annuel de la Society for Immunotherapy of Cancer (SITC)
KIRKLAND, Québec, le 12 novembre 2016 – Merck (NYSE : MRK), connue sous le nom de
MSD à l’extérieur du Canada et des États-Unis, a annoncé aujourd’hui les résultats de l’étude
pivot KEYNOTE-045 évaluant l’utilisation du pembrolizumab, le traitement anti-PD-1 de
l’entreprise, chez les patients atteints d’un cancer de la vessie (tumeur urothéliale) de stade
avancé ayant déjà été traités avec une chimiothérapie à base de platine. Comme annoncé
précédemment, le traitement avec le pembrolizumab s’est révélé supérieur à la chimiothérapie
choisie par l’investigateur sur le plan de la survie globale (SG), paramètre principal de cette
étude de phase III interrompue plus tôt que prévu. En particulier, une réduction de l’ordre de
27 % du risque de décès chez les patients traités avec le pembrolizumab a été observée par
rapport à la chimiothérapie (SG, RR : 0,73; p : 0,0022). Les données présentées au 31e congrès
annuel de la SITC sont les premiers résultats de cette étude à être rendus publics.
« L’amélioration de la survie globale des patients traités dans cette étude avec le
pembrolizumab est significative sur le plan clinique et pourrait influencer la façon dont les
médecins envisagent de soigner les patients déjà traités pour un cancer urothélial de stade
avancé », a déclaré le Dr Roger Dansey, vice-président principal, développement en oncologie
au stade avancé, Laboratoires de recherche de Merck. « Ces nouvelles données s’ajoutent à
l’ensemble de données probantes de plus en plus important de notre programme de

- 2 -
développement clinique du pembrolizumab dans le traitement de divers types de cancer,
notamment le cancer urothélial de stade avancé. »
Les résultats de l’étude ont été présentés par le Dr Joaquim Bellmunt, du Dana-Farber
Cancer Institute, le samedi 12 novembre, entre 11 h 45 et 12 h (HNE) [résumé no 470].
« Peu de progrès ont été réalisés dans le traitement du cancer de la vessie au cours des
dernières décennies, et la chimiothérapie demeurait la seule option », a déclaré le Dr Dean F.
Bajorin, investigateur de l’étude et oncologue au Memorial Sloan Kettering Cancer Center.
« Ces données montrent la capacité potentielle du pembrolizumab d’améliorer de façon
significative la survie globale chez les patients présentant un cancer urothélial de stade avancé
ayant déjà reçu une chimiothérapie à base de platine. »
Le programme de développement clinique du pembrolizumab vise plus de 30 types de
tumeurs dans plus de 360 études cliniques, dont près de 200 portent sur l’association du
pembrolizumab à d’autres antinéoplasiques. À l’heure actuelle, le programme de
développement clinique en immuno-oncologie de Merck sur le cancer de la vessie atteint une
envergure sans précédent, avec 27 études en cours sur le pembrolizumab, en monothérapie et
en association, dont quatre études d’homologation.
Résultats de l’étude KEYNOTE-045
L’étude KEYNOTE-045 est une étude pivot de phase III, avec répartition aléatoire, visant
à évaluer le pembrolizumab en monothérapie, par rapport à une chimiothérapie (paclitaxel,
docétaxel, vinflunine) choisie par l’investigateur, pour le traitement des patients atteints d’un
cancer urothélial (carcinome urothélial du bassinet du rein, de l’uretère, de la vessie ou de
l’urètre) métastatique ou localement avancé, non résécable (inopérable), qui a récidivé ou
progressé après une chimiothérapie à base de platine. Les coparamètres principaux de l’étude
étaient la survie globale (SG) et la survie sans progression (SSP), et les paramètres
secondaires étaient le taux de réponse global (TRG), la durée de la réponse et l’innocuité. Dans
le cadre de cette étude, 542 patients ont été répartis au hasard pour recevoir le pembrolizumab
(200 mg toutes les 3 semaines) [n = 270] ou la chimiothérapie choisie par l’investigateur
(n = 272), à savoir, du paclitaxel (175 mg/m2 toutes les 3 semaines), du docétaxel (75 mg/m2
toutes les 3 semaines) ou de la vinflunine (320 mg/m2 toutes les 3 semaines). L’étude était
conçue de manière à évaluer les paramètres principaux chez des patients dont les cellules
tumorales exprimaient ou non le marqueur PD-L1 (population totale de l’étude : n = 542), de
même que chez des patients dont les cellules tumorales exprimaient le marqueur PD-L1 (taux

- 3 -
d’expression d’au moins 10 %) [n = 74/270 dans le groupe recevant le pembrolizumab;
n = 90/272 dans le groupe recevant la chimiothérapie].
Les résultats présentés lors du congrès annuel de la SITC pour la population totale à
l’étude indiquent une amélioration significative de la SG avec le pembrolizumab,
comparativement à la chimiothérapie, avec une réduction du risque de décès de l’ordre de 27 %
(RR : 0,73 [IC à 95 % : 0,59 à 0,91]; p : 0,0022). La SG médiane dans ce groupe était de
10,3 mois (IC à 95 % : 8,0 à 11,8) avec le pembrolizumab, comparativement à 7,4 mois (IC
à 95 % : 6,1 à 8,3) avec la chimiothérapie. Le taux de SG à un an a été estimé à 43,9 % avec le
pembrolizumab, comparativement à 30,7 % avec la chimiothérapie.
Dans le cadre de l’analyse de la SG chez les patients dont les cellules tumorales
exprimaient le marqueur PD-L1, une réduction de 43 % du risque de décès a été observée avec
le pembrolizumab, comparativement à la chimiothérapie (RR : 0,57 [IC à 95 % : 0,37 à 0,88]; p :
0,0048). La SG médiane était de 8,0 mois (IC à 95 % : 5,0 à 12,3) avec le pembrolizumab,
comparativement à 5,2 mois (IC à 95 % : 4,0 à 7,4) avec la chimiothérapie. Le taux de SG à un
an a été estimé à 39,8 % avec le pembrolizumab, comparativement à 26,9 % avec la
chimiothérapie.
D’après une analyse de la SSP, second paramètre principal de l’étude, la SSP médiane
était de 2,1 mois (IC à 95 % : 2,0 à 2,2) avec le pembrolizumab, comparativement à 3,3 mois
(IC à 95 % : 2,3 à 3,5) avec la chimiothérapie (RR : 0,98; [IC à 95 % : 0,81 à 1,19]; p : 0,42). Le
taux de SSP à six mois était de 28,8 % avec le pembrolizumab, comparativement à 26,8 %
avec la chimiothérapie; le taux de SSP à un an était de 16,8 % avec le pembrolizumab, par
rapport à 6,2 % avec la chimiothérapie.
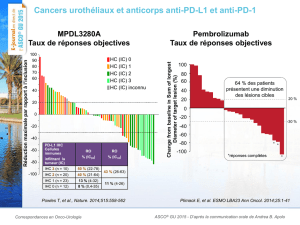
L’écart entre les taux de réponse des deux groupes était de 9,6 % (p : 0,0011), soit une
différence statistiquement significative et en faveur du pembrolizumab. Le TRG était de 21,1 %
avec le pembrolizumab (dont 7,0 % étaient des réponses complètes), comparativement
à 11,4 % avec la chimiothérapie (dont 3,3 % étaient des réponses complètes). Chez les patients
exprimant le marqueur PD-L1, le TRG était de 21,6 % avec le pembrolizumab (dont 6,8 %
étaient des réponses complètes), comparativement à 6,7 % avec la chimiothérapie (dont 2,2 %
étaient des réponses complètes).
La durée médiane de la réponse chez les patients traités avec le pembrolizumab n’avait
pas encore été atteinte au moment de l’analyse (intervalle : 1,6 à 15,6 mois) – avec des
réponses d’une durée estimée d’au moins 12 mois dans 68 % des cas. Dans le groupe recevant
la chimiothérapie, la durée médiane de la réponse était de 4,3 mois (intervalle : 1,4

- 4 -
à 15,4 mois) – avec des réponses d’une durée estimée d’au moins 12 mois dans 35 % des
cas.
Dans cette étude, le profil d’innocuité du pembrolizumab concorde avec celui obtenu au
cours d’études rapportées antérieurement et menées auprès de patients atteints d’un cancer
urothélial de stade avancé. Les effets indésirables liés au traitement observés pendant cette
étude (chez au moins 10 % des patients, tous grades confondus) étaient les suivants : prurit
(19,5 % avec le pembrolizumab; 2,7 % avec la chimiothérapie), fatigue (13,9 % avec le
pembrolizumab; 27,8 % avec la chimiothérapie), nausées (10,9 % avec le pembrolizumab;
24,3 % avec la chimiothérapie), diarrhée (9,0 % avec le pembrolizumab; 12,9 % avec la
chimiothérapie), perte d’appétit (8,6 % avec le pembrolizumab; 16,1 % avec la chimiothérapie),
asthénie (5,6 % avec le pembrolizumab; 14,1 % avec la chimiothérapie), anémie (3,4 % avec le
pembrolizumab; 24,7 % avec la chimiothérapie), constipation (2,3 % avec le pembrolizumab;
20,4 % avec la chimiothérapie), neuropathie sensorielle périphérique (0,8 % avec le
pembrolizumab; 11,0 % avec la chimiothérapie), neuropathie périphérique (0,4 % avec le
pembrolizumab; 10,6 % avec la chimiothérapie), baisse des polynucléaires neutrophiles (0,4 %
avec le pembrolizumab; 14,1 % avec la chimiothérapie), alopécie (37,6 % avec la
chimiothérapie) et neutropénie (15,3 % avec la chimiothérapie). Les effets indésirables à
médiation immunitaire étaient les suivants : troubles thyroïdiens (9,4 % avec le
pembrolizumab;1,6 % avec la chimiothérapie), pneumonite (4,1 % avec le pembrolizumab;
0,4 % avec la chimiothérapie), colite (2,3 % avec le pembrolizumab; 0,4 % avec la
chimiothérapie), réactions liées à la perfusion (0,8 % avec le pembrolizumab; 3,9 % avec la
chimiothérapie), toxicité cutanée sévère (0,8 % avec le pembrolizumab; 1,2 % avec la
chimiothérapie), néphrite (0,8 % avec le pembrolizumab), insuffisance surrénale (0,4 % avec le
pembrolizumab) et myosite (0,4 % avec la chimiothérapie). Quinze patients dans le groupe
recevant le pembrolizumab et 28 dans celui recevant la chimiothérapie ont interrompu leur
traitement en raison d’un effet indésirable lié au traitement; le traitement a entraîné quatre
décès dans chacun des groupes.
À propos du cancer de la vessie
La survenue d’un cancer de la vessie se caractérise par une prolifération incontrôlée des
cellules de la vessie. Cette augmentation anarchique du nombre de cellules peut donner lieu à
la formation d’une tumeur susceptible de se propager ailleurs dans l’organisme. Le carcinome
urothélial, le plus fréquent de tous les cancers de la vessie, prend naissance dans les cellules
urothéliales qui tapissent l’intérieur de la vessie. En 2012, environ 430 000 personnes partout

- 5 -
dans le monde ont reçu un diagnostic de cancer de la vessie, et 165 000 sont décédées des
suites de la maladie. L’incidence du cancer de la vessie est élevée en Amérique du Nord, en
Europe, en Afrique du Nord, au Moyen-Orient, en Australie et en Nouvelle-Zélande.
À propos du pembrolizumab1
Le pembrolizumab est un anticorps monoclonal humanisé qui agit en renforçant le
système immunitaire de l’organisme, de sorte que celui-ci est mieux armé pour déceler et
combattre les cellules tumorales. Le pembrolizumab bloque l’interaction entre le PD-1 et ses
ligands, le PD-L1 et le PD-L2. Ce faisant, il active des lymphocytes T qui peuvent agir autant
sur les cellules tumorales que sur les cellules saines.
Au Canada, le pembrolizumab, connu sous le nom de KEYTRUDA®, est indiqué pour le
traitement des patients atteints d’un mélanome non résécable ou métastatique n’ayant jamais
été traités avec l’ipilimumab. KEYTRUDA® a reçu une autorisation de commercialisation sans
condition. Les sujets atteints d’un mélanome à mutation BRAF V600 peuvent avoir été traités au
moyen d’un inhibiteur du gène BRAF.
KEYTRUDA est aussi indiqué pour le traitement du mélanome non résécable ou
métastatique avec progression de la maladie à la suite d’un traitement avec l’ipilimumab et, en
présence d’une mutation V600 du gène BRAF, à la suite d’un traitement avec un inhibiteur du
gène BRAF ou de la protéine MEK, ainsi que pour le traitement des patients atteints d’un
cancer du poumon non à petites cellules (CPNPC) métastatique avec une tumeur exprimant le
PD-L1 (tel que déterminé par un test validé), qui a progressé durant ou après une
chimiothérapie à base de platine. Chez les patients présentant des aberrations génomiques
tumorales du gène EGFR ou ALK, une progression de leur maladie doit être constatée au cours
d’un traitement autorisé pour ces aberrations avant que KEYTRUDA leur soit administré.
Aucune amélioration du taux de survie ou des symptômes associés à la maladie n’a encore été
observée. KEYTRUDA bénéficie de ces autorisations de commercialisation avec conditions, en
attendant les résultats d’études permettant d’attester son bienfait clinique.
KEYTRUDA est administré à une dose de 2 mg/kg par perfusion intraveineuse durant
30 minutes, toutes les 3 semaines pour les indications approuvées.
Pour consulter l’intégralité de la monographie canadienne du produit et ainsi obtenir les
renseignements d’ordonnance complets, y compris les contre-indications, les mises en garde,
les précautions, les effets indésirables, les interactions médicamenteuses, la posologie et les
conditions d’utilisation clinique, veuillez cliquer ici.
 6
6
 7
7
1
/
7
100%