ATB STAPH: Antibiogramme Staphylocoques - Notice Technique

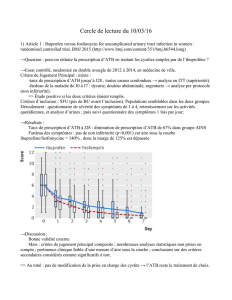
Français - 1 bioMérieux sa
14 029 08801D - FR - 2001/06
ATB STAPH Pour diagnostic in vitro
Antibiogramme pour les staphylocoques
PRINCIPE
Les galeries ATB STAPH permettent de déterminer la
sensibilité des staphylocoques aux antibiotiques en milieu
semi-solide dans des conditions très proches de la
technique de référence (dilution en gélose).
Les galeries ATB STAPH comportent 16 paires de
cupules. La première, sans antibiotique, sert de témoin de
culture. Les 14 suivantes contiennent des antibiotiques à
une ou deux concentrations (c et C). La dernière paire,
sans antibiotique, permet, si besoin, d'ajouter un
antibiotique supplémentaire (test unitaire).
La bactérie à tester est mise en suspension puis
transférée dans le milieu de culture et inoculée dans la
galerie. Après 18-24 heures d'incubation, la lecture de la
croissance se fait soit visuellement, soit avec l'automate
ATB ou mini API. Le résultat obtenu permet de
catégoriser la souche Sensible, Intermédiaire ou
Résistante.
REACTIFS
Composition du coffret (25 antibiogrammes) :
- 25 galeries ATB STAPH en emballage individuel
avec déshydratant
- 25 couvercles d'incubation
- 25 ampoules d'ATB Na Medium 2 %
- 1 notice technique
Produits complémentaires non fournis
(* Produits disponibles chez bioMérieux -
consulter tarif ou bioMérieux pour leur référence) :
- Suspension Medium (*)
- ATB Medium (*)
- Embouts (*) pour Pipette Electronique ATB (*)
ou Inoculateur ATB
- McFarland Standard (*) ou Densitomètre ATB (*)
- Automate ATB ou mini API avec logiciel (*)
- Protège-ampoules (*)
- Portoir pour ampoules (*)
- Antibiotiques en tests unitaires si nécessaire
Matériel de laboratoire nécessaire :
- Etuve à 35-37°C
- Réfrigérateur
- Bec Bunsen
- Crayon marqueur
CONSERVATION DES GALERIES ET MILIEUX
Les galeries et milieux se conservent à 2-8°C à l'obscurité
jusqu'à la date limite d'utilisation indiquée sur l'emballage.
COMPOSITION DES MILIEUX
Suspension Medium Eau déminéralisée
ATB Medium Mueller Hinton 1000 ml
Glucose 2 g
Ca++ qsp 50 mg
Mg++ qsp 20 mg
Agar 1,5 g
pH : 7,2 - 7,4
ATB Na Medium 2 % Mueller Hinton 1000 ml
Glucose 2 g
NaCl 20 g
Ca++ qsp 50 mg
Mg++ qsp 20 mg
Agar 1,5 g
pH : 7,2 - 7,4
UTILISATION DES MILIEUX ATB MEDIUM
ET ATB NA MEDIUM 2 %
• Ces milieux se présentent en ampoules autosécables
munies d'un bouchon.
• Bien que contenant de la gélose, ils ne nécessitent pas
de fusion préalable et se pipettent comme un milieu
liquide.
Il est cependant préférable de ramener les ampoules à
la température ambiante en les sortant du réfrigérateur
quelques heures avant leur utilisation.
• Ne pas agiter.
• Ouvrir les ampoules comme indiqué au paragraphe
"Précautions de Sécurité".
PRECAUTIONS DE SECURITE
• Destiné au diagnostic in vitro seulement.
• Pour usage professionnel uniquement.
• Ne pas pipeter à la bouche.
• Ouvrir les ampoules délicatement comme suit :
- Placer l'ampoule dans le protège-ampoules.
- Tenir l'ensemble verticalement dans une
main (bouchon blanc vers le haut).
- Bien enfoncer le bouchon.
- Recouvrir la partie inclinée du bouchon avec
la première phalange du pouce.
- Exercer une pression avec le pouce à la
base de la partie inclinée du bouchon avec
un mouvement vers l'extérieur de façon à
casser l'extrémité de l'ampoule à l'intérieur
du bouchon.
- Retirer l'ampoule du protège-ampoules et
conserver le protège-ampoules pour une
utilisation ultérieure.
- Enlever délicatement le bouchon.
• Tous les produits inoculés doivent être considérés
comme potentiellement infectieux et manipulés de façon
appropriée.
• Les prélèvements et cultures bactériennes doivent être
considérés comme potentiellement infectieux et doivent
être manipulés de façon appropriée par un personnel
compétent et averti. Les techniques aseptiques et les
précautions usuelles de manipulation pour le groupe
bactérien étudié doivent être respectées tout au long de
la manipulation ; se référer à "NCCLS M29-A, Protection
of Laboratory Workers from Instrument Biohazards and
Infectious Disease Transmitted by Blood, Body Fluids,
and Tissue; Approved Guideline - December 1997".
Pour informations complémentaires sur les précautions
de manipulation, se référer à "Biosafety in Micro-
biological and Biomedical Laboratories, HHS Publication
No. (CDC) 93-8395, 3rd Edition (May 1993)," ou à la
réglementation en vigueur dans le pays d'utilisation.
• A la fin du test, après lecture et interprétation, tous les
prélèvements, souillures et produits inoculés (ampoules,
embouts, galeries et couvercles) doivent être auto-
clavés, incinérés ou immergés dans un désinfectant
germicide avant élimination.
• Les performances présentées sont obtenues avec la
méthodologie indiquée dans cette notice. Toute dé-
viation de méthodologie peut altérer les résultats.
• L'interprétation des résultats du test doit être faite par un
microbiologiste compétent qui prendra en considération
le contexte clinique, l'origine du prélèvement, les
aspects macro et microscopiques et éventuellement les
résultats d'autres tests.

ATB STAPH 08801D - FR - 2001/06
Produit enregistré à l’Agence Française de Sécurité Sanitaire des Produits de Santé
bioMérieux sa
au capital de 77 421 420 F
673 620 399 RCS LYON
69280 Marcy-l'Etoile / France
Tél. 33 (0)4 78 87 20 00 / Fax 33 (0)4 78 87 20 90
http://www.biomerieux.com Imprimé en France
MODE OPERATOIRE
Préparation de la galerie
• Sortir la galerie de son emballage.
• Jeter le déshydratant.
• Noter le numéro de la souche sur la languette latérale.
• Eventuellement, intégrer un test unitaire à la galerie.
Préparation de l'inoculum
• Préparer une suspension bactérienne d'opacité équiva-
lente à l'étalon 2 de McFarland. Comparer à un témoin
d'opacité ou utiliser le Densitomètre.
Deux méthodes :
- culture en bouillon pendant 2 à 4 heures, jusqu'à
obtention de l'opacité indiquée ;
- mise en suspension de 1 ou plusieurs colonies dans
une ampoule de Suspension Medium (ouvrir l'ampoule
comme indiqué au paragraphe "Précautions de
Sécurité").
• A l'aide d'une pipette, transférer 200 µl de cette
suspension dans une ampoule d'ATB Medium et
200 µl dans une ampoule d'ATB Na Medium 2 % (pour
le test OXA).
Inoculation de la galerie
• Inoculation MANUELLE :
- Homogénéiser ATB Medium avec la Pipette
Electronique ATB en évitant la formation de bulles
et répartir 135 µl (environ 2x107 bactéries/ml ou
2x106 bactéries/cupule) avec la Pipette Electronique
ATB dans chaque cupule de la galerie exceptée OXA.
- Homogénéiser ATB Na Medium 2 % avec la Pipette
Electronique ATB en évitant la formation de bulles
et répartir 135 µl (environ 2x107 bactéries/ml ou
2x106 bactéries/cupule) avec la Pipette Electronique
ATB dans la cupule OXA.
• Inoculation AUTOMATIQUE :
- Déposer sur un plateau de l'Inoculateur ATB, une
galerie, l'ampoule d'ATB Medium, l'ampoule d'ATB
Na Medium 2 % et un embout ATB.
- L'inoculateur réalise automatiquement l'homo-
généisation d'ATB Medium et d'ATB Na Medium 2 % ,
et le remplissage des cupules.
• Mettre un couvercle sur la galerie.
• Incuber 18-24 heures à 35-37°C en aérobiose. Une
incubation proche de 24 heures est toutefois recommandée
pour les staphylocoques à coagulase négative.
Lecture de la galerie et interprétation
• Rechercher dans chaque cupule la présence d'un
trouble (+) par lecture visuelle ou automatique.
Pour les antibiotiques testés à deux concentrations :
Aspect des cupules Résultats La souche est :
c C c C
clair
trouble
trouble
clair
clair
trouble
–
+
+
–
–
+
S
I
R
SENSIBLE
INTERMEDIAIRE
RESISTANTE
Pour les antibiotiques testés à une seule concentration :
Aspect de la cupule Résultat La souche est :
clair
trouble
–
+
S
R
SENSIBLE
RESISTANTE
- L'absence de croissance dans les deux cupules-témoin
invalide l'antibiogramme qui doit être recommencé.
- Un résultat c(–)C(+) est un non-sens (N) : répéter le test
avec une nouvelle galerie.
- En lecture visuelle, une croissance limitée à la
périphérie de la cupule doit être lue négative.
NOTES :
Les concentrations utilisées pour les molécules suivantes
sont différentes de celles préconisées par le Comité de
l'Antibiogramme de la Société Française de Microbiologie
(CASFM) :
- rifampicine : 0.25-16 mg/l au lieu de 0.5-16 mg/l
(CASFM). Les souches sauvages sont rendues
sensibles mais quelques souches présentant un faible
niveau de résistance pour cet antibiotique peuvent être
rendues intermédiaires alors qu'elles restent sensibles
d'après les recommandations du CASFM.
- pristinamycine : 2 mg/l au lieu de 1-2 mg/l (CASFM).
De rares souches catégorisées I selon les recomman-
dations du CASFM peuvent être rendues S.
- nitrofurantoïne : 25-100 mg/l au lieu de 32-128 mg/l
(CASFM). Il n'y a pas d'impact significatif sur les
catégorisations.
CONTROLE DE QUALITE
Souche test
Pour vérifier la standardisation de la méthode suivie,
il faut réaliser des contrôles de qualité périodiques avec la
souche test indiquée pour cette galerie.
Causes d'erreurs qui peuvent affecter les résultats
• Cultures mixtes ou contaminées.
• Mauvaise standardisation de l'inoculum.
• Mauvaise conservation du témoin d'opacité.
• Erreur de milieu.
• Emploi de galeries / milieux périmés ou mal conservés.
• Temps d'attente trop longs entre les diverses étapes de
la manipulation (de la préparation de l'inoculum à
l'incubation des galeries).
• Température et durée d'incubation non respectées.
• Absence de contrôle de qualité.
PERFORMANCES
La nouvelle méthodologie ATB STAPH permet d'améliorer
la détection de la résistance à l'oxacilline sans modifier le
niveau de performance habituel obtenu pour les autres
molécules. Ainsi, une étude, portant sur 152 souches de
staphylocoques dorés et 150 souches de staphylocoques
à coagulase négative génétiquement caractérisées quant
à leur statut vis-à-vis de l'oxacilline (144 Résistantes,
mecA+; 158 Sensibles, mecA-), a montré les résultats
suivants comparativement aux méthodes de référence
(dilution en milieu gélosé, DEG, 2% et 4% NaCl) et de
diffusion (30°C) :
Sensibilité (%) Spécificité (%)
ATB STAPH 90 93
DEG 2% 68 97
DEG 4% 80 97
Diffusion 78 94
Concernant les autres molécules, un changement de
catégorisation de S vers I ou R est noté pour 2,3% des
tests. Ce changement est apparu le plus souvent justifié,
permettant fréquemment une amélioration de la détection
des mécanismes de résistance faiblement exprimés.
BIBLIOGRAPHIE p. I
CONTROLE DE QUALITE p. II
FICHE DE RESULTATS p. III
1
/
2
100%