Adénome hypophysaire - polys-ENC

©Collège des Enseignants d’Endocrinologie, Diabète et Maladies Métaboliques. Mise à jour décembre 2004
www.endocrino.net Page 1 sur 11
Item 220 : Adénome hypophysaire
Objectifs pédagogiques terminaux : « diagnostiquer un adénome hypophysaire »
- Bénins, les adénomes hypophysaires sont des tumeurs bien différenciées, de croissance habituellement
lente sur plusieurs années, développées de manière monoclonale à partir des cellules endocrines anté-
hypophysaires. Ils représentent 10 % des tumeurs intracrâniennes.
- On distingue les microadénomes dont le plus grand diamètre est inférieur à 10 mm, et les
macroadénomes qui peuvent représenter de volumineuses tumeurs envahissantes.
- Les adénomes peuvent être non-sécrétants, révélés alors par le syndrome tumoral associé
éventuellement à des signes d’hypopituitarisme, ou sécrétants : les prolactinomes, les plus fréquents,
entraînent le classique syndrome aménorrhée-galactorrhée; les adénomes somatotropes sont
responsables de l’acromégalie; les adénomes corticotropes entraînent une maladie de Cushing et les
adénomes thyréotropes, plus rares, une hyperthyroïdie.
Etiopathogénie
Elle a fait l’objet de nombreux travaux récents. La démonstration du caractère monoclonal de ces
tumeurs a montré qu’elles prenaient leur origine dans une prolifération des cellules hypophysaires, même si
des facteurs extérieurs à ces cellules (facteurs de croissance, hormones hypothalamiques...) peuvent jouer
un rôle promoteur.
L’immense majorité des adénomes hypophysaires survient de manière sporadique, mais certaines
pathologies familiales peuvent s’accompagner d’une fréquence accrue d’adénomes hypophysaires. C’est le
cas de la Néoplasie Endocrinienne Multiple de type 1, dont le gène est désormais connu, qui associe une
hyperparathyroïdie, quasi-constante, à d’autres atteintes glandulaires, concernant essentiellement le
pancréas endocrine (gastrinomes, insulinomes) et l’hypophyse.
Diagnostic
Selon leurs caractéristiques morphologiques (taille, extension tumorale) et fonctionnelles, les adénomes
hypophysaires peuvent se manifester par un ou plusieurs des éléments de la triade symptomatique :
syndrome tumoral, avec ses manifestations cliniques et radiologiques, hypersécrétion d'une ou plusieurs
hormones anté-hypophysaires, déficit hormonal touchant une ou plusieurs des lignées hormonales
hypophysaires, avec leurs manifestations cliniques et biologiques. En dehors de ces circonstances
classiques un nombre croissant d’adénomes est découvert lors de l’exploration d’une masse hypophysaire
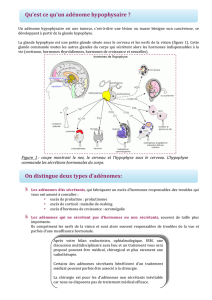
de découverte fortuite. La démarche diagnostique face a cette situation est schématisée sur la figure 1.

©Collège des Enseignants d’Endocrinologie, Diabète et Maladies Métaboliques. Mise à jour décembre 2004
www.endocrino.net Page 2 sur 11
Ces différentes manifestations résultent directement des bases anatomo-physiologiques de la région
hypothalamo-hypophysaires (Tableau 1).
L'hypophyse est en effet une glande formée d’un lobe antérieur (antéhypophyse) sécrétant plusieurs
hormones dans la circulation générale, et d’un lobe postérieur (post-hypophyse) dans lequel aboutissent les
axones de neurones hypothalamiques sécrétant ocytocine et vasopressine (hormone anti-diurétique ou
ADH ou AVP). L’antéhypophyse est sous le contrôle d’hormones hypothalamiques sécrétées dans le
système porte hypothalamo-hypophysaire et reliée à la région hypothalamique par la tige pituitaire au
niveau du troisième ventricule. Elle est située dans une loge inextensible, constituée par la selle turcique
de l'os sphénoïde en bas, en avant et en arrière, le diaphragme sellaire tapissé par les méninges en haut, et
les parois du sinus caverneux latéralement. Celui-ci est traversé par la carotide interne intracrânienne,
les portions ophtalmique et maxillaire du nerf trigéminé (V1 et V2), et par les nerfs oculomoteurs (III, IV
et VI). La proximité du chiasma optique, croisement des voies optiques, au-dessus de la loge hypophysaire
explique le risque visuel en cas de pathologie expansive suprasellaire
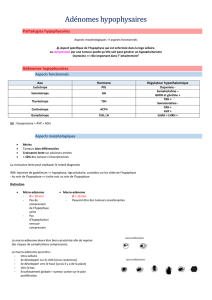
Tableau 1 Bases fonctionnelles de l’antéhypophyse, montrant les différents types cellulaires (lignées),
leur sécrétion hormonale, et leurs régulateurs hypothalamiques principaux, stimulateurs (+) ou inhibiteurs
(-).
lignée hormone hypophysaire hormone hypothalamique
lactotrope prolactine (PRL) dopamine (-)
somatotrope hormone de croissance somatostatine (-)
(GH =Growth hormone) GHRH (+) (GH Releasing Hormone)
GH sécrétagogue (+) (Ghréline)
thyréotrope thyréotropine (TSH = TRH (+) (Thyrotropin Releasing Hormone)
thyreo Stimulating Hormone) somatostatine (-)
corticotrope corticotropine (ACTH= CRH (+) (Corticotropin Releasing Hormone)
Adrenocorticotropic Hormone) AVP (+) (Arginine Vasopressin)
gonadotrope gonadotropines (FSH= LHRH ou GnRH (+) (LH ou Gonadotropin Releasing
Hormone)
Folliculo Stimulating Hormone,
LH= Luteotropic Hormone
Syndrome tumoral
1 - Clinique
Les céphalées sont typiquement frontales ou orbitaires, avec irradiations fréquentes au vertex. Peu
spécifiques, non pulsatiles, elles sont généralement calmées par les antalgiques habituels. Elles sont
présentes même en cas de microadénomes, par mise en tension du diaphragme sellaire.
Les réductions du champ visuel sont observées seulement en cas de macroadénome ayant une extension
suprasellaire atteignant les voies optiques. Du fait de la répartition des fibres nerveuses au niveau du
chiasma, le champ temporal de chaque côté est le premier touché. L'intensité de l'atteinte est croissante
avec le degré de la compression : exclusion de la tâche aveugle (Fig 2), aplatissement des isoptères,
quadranopsie temporale supérieure, puis la typique hémianopsie bitemporale, jusqu'à la cécité. L'expansion
suprasellaire étant souvent médiane et le retentissement est le plus souvent bilatéral. L’examen du champ
visuel (campimétrie de Goldman, ou encore champ visuel automatisé) sera complété par une mesure de
l’acuité visuelle et un examen du fond d’œil.
La diplopie est observée en cas de compression d'un nerf oculomoteur du fait d'une extension tumorale
dans le sinus caverneux. Elle peut être explorée par un test de Lancaster.

©Collège des Enseignants d’Endocrinologie, Diabète et Maladies Métaboliques. Mise à jour décembre 2004
www.endocrino.net Page 3 sur 11
Une apoplexie hypophysaire, correspondant à une brusque hémorragie intra-adénomateuse, peut entraîner
un tableau évoquant une hémorragie méningée, avec céphalées intenses d'apparition brutale, fébricule,
diplopie, syndrome confusionnel.
2 - Neuroradiologie
En cas de suspicion d'adénome hypophysaire fondée sur des éléments cliniques, éventuellement
confirmés par des éléments biologiques l'exploration morphologique à pratiquer est une imagerie en
résonance magnétique (IRM) hypophysaire. L'IRM a prouvé sa supériorité sur la tomodensitométrie
dans les microadénomes comme dans les macroadénomes. Le scanner peut parfois être utilisé pour des
raisons d'accessibilité ou pour mieux explorer le cadre osseux. L'IRM permet actuellement de
détecter des microadénomes de 2 ou 3 mm, sous la forme d'une anomalie de signal arrondie intra-
parenchymateuse. Toutefois, ce type d'image peut être observé chez près de 10 % de sujets témoins ("
incidentalomes hypophysaires ") et ne doit donc être interprété qu'en fonction du contexte clinique et
biologique.
La radiographie simple du crâne, même centrée sur la selle turcique ne possède pas une sensibilité
suffisante et ne doit donc pas être demandée à titre diagnostique.
Syndromes d'hypersécrétion
1 - Hyperprolactinémie
Le retentissement endocrinien de l'hyperprolactinémie se manifeste assez précocement chez la femme non
ménopausée sous la forme de troubles du cycle (oligospanioménorrhée, aménorrhée), d'une galactorrhée,
de troubles sexuels (baisse de la libido, sécheresse vaginale, dyspareunie), et parfois seulement sous
forme d'une infertilité par anovulation avec conservation des cycles. Le mécanisme de l'atteinte de la
fonction gonadique est une inhibition de la libération de LHRH (luteinizing hormone releasing hormone)
hypothalamique induite par l'excès de prolactine. Chez la femme ménopausée, la galactorrhée est rare et
c'est le syndrome tumoral qui est révélateur. Chez l'homme, les manifestations, conduisant plus
tardivement au diagnostic que chez la femme jeune, sont représentées par des troubles sexuels (baisse de
libido, dysérection, impuissance érectile), raréfaction de la pilosité faciale ou somatique et rarement
gynécomastie voire galactorrhée.
Les complications de l'hyperprolactinémie sont liées à l’atteinte de la fonction gonadique: essentiellement
l’infertilité et l’ostéoporose en cas d’hyperprolactinémie prolongée.
Sur le plan biologique, la prolactinémie basale est trouvée élevée, supérieure à 20 µg/l. Le taux basal de
prolactine est généralement bien corrélé avec le volume tumoral, un taux supérieur à 200 µg/L étant quasi-
spécifique d'un macroprolactinome. Au contraire, un taux inférieur à 100 µg/L en présence d'un
macroadénome volumineux est en faveur d'une hyperprolactinémie accompagnant un adénome non-
sécrétant par un mécanisme de compression de la tige pituitaire. À la différence des hypogonadismes
d'origine ovarienne, les taux de gonadotrophines (LH et FSH) ne sont pas augmentés. En cas
d'insuffisance gonadotrope lésionnelle associée, les gonadotrophines seront même abaissées en base ou
après stimulation par LHRH exogène (test au LHRH).
2 - Acromégalie
Le tableau clinique lié à l’hypersécrétion chronique de GH est caractérisé par l'installation progressive et
insidieuse de modifications morphologiques : prognathisme (Fig 3), élargissement des mains et des pieds
nécessitant des changements de pointure de chaussures, épaississement des traits, en particulier le nez et
les lèvres. Ces signes passent souvent inaperçus du patient et de son entourage, et seront mis en évidence
par la comparaison de clichés successifs (documents d'identité par exemple). On note également une
hypersudation, une hyperséborrhée, parfois une hypertrichose ; des troubles de l'articulé dentaire et une
macroglossie, avec fréquents ronflements nocturnes, une raucité de la voix ; des arthralgies, un syndrome

©Collège des Enseignants d’Endocrinologie, Diabète et Maladies Métaboliques. Mise à jour décembre 2004
www.endocrino.net Page 4 sur 11
du canal carpien; une hépato-splénomégalie. Une hypertension artérielle, une intolérance au glucose ou un
diabète sucré peuvent apparaître.
Les complications de l'acromégalie sont surtout liées à l'ancienneté de l'hypersécrétion somatotrope.
L'insuffisance cardiaque peut être la conséquence de la cardiopathie acromégalique associée à
l'hypertension artérielle. Sur le plan respiratoire, les déformations thoraciques peuvent entraîner un
syndrome restrictif et le syndrome d'apnée du sommeil est fréquent, responsable notamment d'une
somnolence diurne. Le diabète, le plus souvent non insulinodépendant, peut entraîner toutes ses
complications propres. La fréquence accrue des polypes et du cancer du côlon justifie un dépistage
systématique initial par colonoscopie. Un accroissement éventuel du risque d'autres types de cancers
n’est pas formellement démontré. L’ensemble de ces complications rend compte d’une multiplication du
taux de mortalité par deux ou trois par rapport à une population de référence. Si le retentissement
osseux et articulaire est irréversible, les conséquences sur la mortalité peuvent être évitées par un
traitement approprié.
La confirmation biologique est apportée par le test de charge orale en glucose au cours duquel le taux de
GH est normalement freiné en dessous de 1 µg/L. Du fait de la pulsatilité de la sécrétion de GH, un
dosage basal isolé de cette hormone n’a aucune valeur ; seuls des dosages répétés de GH au cours des 24
heures (par exemple une mesure horaire pendant 8 heures) peuvent permettre d’apprécier le degré
d’hypersécrétion de l’hormone. En revanche, un dosage unique de l’effecteur périphérique de l’action de
GH, l’IGF-1 (Insulin-like growth factor 1) permet de confirmer le diagnostic d’acromégalie lorsqu’il est
trouvé supérieur à la normale pour l’âge et le sexe. On peut observer une élévation paradoxale de la GH au
cours du test au TRH.
3 - Maladie de Cushing
Cliniquement, l'hypercorticisme induit par l'hypersécrétion chronique d'ACTH entraîne une prise de poids
de type androïde, c’est-à-dire prédominant à la partie supérieure du corps (thorax, abdomen), contrastant
avec des membres rendus grêles par l'amyotrophie. Le faciès est rond, érythrosique. On note des
vergetures pourpres (Fig 4), des ecchymoses apparaissant lors de traumatismes minimes, une
hypertrichose, parfois des œdèmes des membres inférieurs. Les irrégularités menstruelles sont
habituelles. Il peut apparaître un état dépressif ou des troubles du comportement. Une hypertension
artérielle apparaît ou s'aggrave. Il peut exister une hypokaliémie.
vergetures pourpres chez une patiente atteinte de maladie de Cushing

©Collège des Enseignants d’Endocrinologie, Diabète et Maladies Métaboliques. Mise à jour décembre 2004
www.endocrino.net Page 5 sur 11
Les complications de la maladie de Cushing sont les mêmes que celles d'une corticothérapie au long cours,
avec un risque de mortalité : risque accru d'infection notamment à germes opportunistes; déminéralisation
osseuse avec risque de fractures vertébrales, cervico-fémorales ou des os longs ; décompensation
psychiatrique ; hypokaliémie sévère, hypertension artérielle ou diabète compliqués ; phlébites ou embolies
pulmonaires.
Le diagnostic biologique d’hypercortisolisme est souvent difficile et comporte deux aspects.
Le diagnostic positif de l’hypercorticisme repose sur l’augmentation de la cortisolémie basale, de
préférence mesurée le soir, ou à plusieurs reprises au cours des 24 heures, montrant une perte du rythme
nycthéméral ; une élévation du cortisol libre urinaire des 24 heures ; et sur l’absence de freinage de
l’hypercorticisme au cours d’un test à la dexaméthasone “ minute ” (1 mg au coucher, et mesure du cortisol
le lendemain à 8 heures), ou “ faible ”, (“ test de Liddle ” faible comportant la prise de 2 mg/jour de
dexaméthasone à raison de 0,5 mg toutes les 6 heures pendant 48 heures).
Le diagnostic étiologique repose sur un faisceau d’arguments cliniques, biologiques et radiologiques qui
permettent de distinguer l’hypercorticisme lié à un adénome corticotrope (dénommé “ maladie ” de
Cushing), qui représente environ 2/3 des causes de syndromes de Cushing endogènes, d’une autre cause,
essentiellement adénome surrénalien ou sécrétion ectopique d’ACTH. Les moyens de ce diagnostic sont
donc développés dans la partie “ diagnostic différentiel ”.
4 - Hyperthyroïdie haute
L'adénome thyréotrope entraîne les mêmes signes que les autres causes de thyrotoxicose : tachycardie,
amaigrissement, hypersudation et thermophobie, diarrhée motrice, nervosité, fatigabilité. Il s'y associe
un goitre le plus souvent de volume modéré.
Les complications des hyperthyroïdies hautes sont les mêmes que celles des autres causes de
thyrotoxicose, essentiellement le risque de cardiothyréose.
Le profil biologique typique est celui d’une élévation des fractions libres des hormones thyroïdiennes T3 et
T4, associée à un taux de TSH dans les limites de la normale (mais dans ce cas inapproprié au taux de T3
et T4) ou élevé, en général de façon modeste. La sous-unité alpha libre de la TSH est élevée, avec un
rapport molaire par rapport à la TSH supérieur à 1.
Syndromes d'hyposécrétion
1 - Déficit corticotrope
Cliniquement, asthénie croissante au cours de la journée, hypotension orthostatique, pâleur, anorexie ou
nausées sont les principaux symptômes. Une perte de pilosité sexuelle peut être observée chez la femme.
À la différence des insuffisances surrénales périphériques, il n'y a pas de mélanodermie, et du fait de la
préservation de la fonction minéralocorticoïde, il n'y a pas d'anomalie ionique en dehors d'une éventuelle
décompensation.
L’exploration hormonale montre un cortisol libre urinaire bas, une cortisolémie abaissée le matin, et des
mesures répétées pendant les 24 heures caractérisées par des taux bas de cortisol en regard de taux
d’ACTH bas ou “ normaux ” mais inappropriés. L’atténuation de la réponse d’ACTH et cortisol au cours
d’une hypoglycémie insulinique, ou encore lors d’un test à la métopirone (dosage du composé S), peut aider
à confirmer le diagnostic en cas de doute.
2 - Déficit gonadotrope
Au plan clinique, les troubles du cycle chez la femme, une dépilation chez l’homme (Fig 5), des troubles de
la fonction sexuelle et de la fertilité dans les deux sexes sont les conséquences de l’hypogonadisme par
atteinte lésionnelle des cellules gonadotropes.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%