Update - IDEXX Diavet

Diagnostic
Update
Hypothyroïdie chez le chien
L’hypothyroïdie est une dysendocrinie fréquente chez le chien. Chez certains patients, il est particulière-
ment difficile d'établir un diagnostic car cette pathologie peut se développer pendant des années à bas
bruit sous des manifestations cliniques très diverses. En outre, les examens de laboratoire actuellement
disponibles présentent certaines limites. En particulier, les résultats de ces examens peuvent être influen-
cés par la présence d’autres maladies ou l’administration de certains médicaments ; de ce fait leur inter-
prétation peut s’avérer difficile. La mise en évidence d’une baisse de la concentration en T4 totale ne suffit
pas à elle seule à établir le diagnostic d’hypothyroïdie.
Octobre 2015
Étiologie
Selon la localisation de la lésion au niveau de l’axe hypothala-
mo-hypophyso-thyroïdien il est possible de différencier 3 formes
d’hypothyroïdie acquise.
Hypothyroïdie primaire
Plus de 95 % des hypothyroïdies acquises chez le chien sont
liées à une diminution de la synthèse des hormones thyroï-
diennes et de leur sécrétion par la thyroïde.
Dans la plupart des cas, cette insuffisance est provoquée par
une thyroïdite lymphocytaire (environ 50 %) (Graham et al.
2007) ou une atrophie idiopathique. La thyroïdite lymphocy-
taire entraîne une inflammation de la thyroïde à médiation im-
mune. Il est ainsi possible de mettre en évidence des auto-an-
ticorps anti-thyroglobuline (Ac anti-TG) et, dans certains cas,
des anticorps anti-T3 et anti-T4 . Cette destruction progressive
d’origine inflammatoire des follicules thyroïdiens est un proces-
sus à évolution lente, et les signes cliniques n’apparaissent que
lorsque plus de 75 % de la glande est détruite.
Lors d’atrophie idiopathique, un tissu conjonctif vient remplacer
le tissu glandulaire thyroïdien fonctionnel et les anticorps anti-TG
ne sont pas (ou plus ?) décelables. Cette atrophie pourrait repré-
senter un processus pathologique autonome ou bien le stade
terminal de la thyroïdite lymphocytaire (Scott-Moncrieff 2015),
mais aucune de ces hypothèses n’a été encore clairement
établie. Plus rarement, l’hypothyroïdie peut être causée par un
processus néoplasique ou une hyperplasie adénomateuse.
Le développement d’une hypothyroïdie atrophique se déroule
en 4 phases, si l’on part de l’hypothèse que l’atrophie idiopa-
thique représente le stade final de la thyroïdite lymphocytaire
(Graham et al. 2007) :
1. Thyroïdite subclinique
Aucun symptôme clinique
Ac anti-TG positif, T4 totale dans l’intervalle de référence,
TSH < 0,5 ng/ml
2. Hypothyroïdie subclinique
Aucun symptôme clinique
Destruction d’environ 60 %-70 % de la thyroïde
Ac anti-TG positif, T4 totale dans l’intervalle de référence,
TSH élevée
3. Hypothyroïdie anticorps-positive
Symptômes cliniques
Destruction d’environ 75 % de la thyroïde
Présence d’anticorps anti-TG, T4 totale basse, TSH élevée
4. Hypothyroïdie atrophique non inflammatoire
Symptômes cliniques manifestes
Le tissu thyroïdien a été remplacé par un tissu adipeux et
conjonctif
Anticorps anti-TG non (ou plus) décelables, T4 totale
basse, TSH élevée
L’hypothyroïdie secondaire (liée à une diminution de la
sécrétion de TSH par l’hypophyse) est une cause très peu fré-
quente d’hypothyroïdie (< 5 %). Elle peut être provoquée par
une hypoplasie hypophysaire s’accompagnant d’un nanisme
d'origine hypophysaire, un traumatisme, une tumeur ou des
lésions kystiques (Scott-Moncrieff 2015).
Son diagnostic s’avère réellement difficile car la sensibilité dia-
gnostique des dosages de la TSH actuellement disponibles ne
suffit pas pour différencier les concentrations physiologiques
de la TSH des concentrations hormonales trop basses. De ce
fait, il ne faut pas exclure que la fréquence des hypothyroïdies
secondaires pourrait être plus élevée (Scott-Moncrieff 2015).
Jusqu’à présent, seule une publication a présenté un cas cli-

nique d’hypothyroïdie tertiaire (liée à une baisse de sécré-
tion de TRH par l’hypothalamus) (Shiel et al. 2007). L’hypo-
thyroïdie congénitale reste rare chez le chien. Néanmoins son
incidence réelle pourrait être sous-estimée, car elle conduit
souvent au décès précoce des chiots atteints. (Scott-Moncrieff
2015).
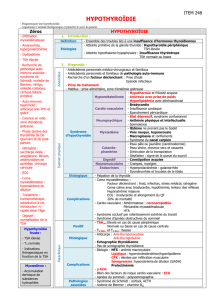
Régulation
La synthèse et la sécrétion des hormones thyroïdiennes sont
sous le contrôle de la TSH sécrétée par l’adénohypophyse (ou
antéhypophyse) qui, elle-même, est contrôlée par la sécré-
tion de la TRH hypothalamique. Sous l’influence de la TSH,
la sécrétion thyroïdienne de T3 et T4 augmente. La T4 est exclu-
sivement synthétisée par la thyroïde, tandis qu’environ 80 % de
la T3 se forme par conversion périphérique (désiodation) dans
les cellules cibles. Les hormones thyroïdiennes circulantes
sont liées aux protéines plasmatiques, mis à part une très
faible quantité (environ 1 %) qui se trouve sous forme libre. Elle
représente la fraction métaboliquement active des hormones
thyroïdiennes, ou T3 libre (fT3) et T4 libre (fT4). La T3 libre et
la T4 libre sont les seules hormones permettant un feed-back
négatif sur l’hypophyse et l’hypothalamus. Si la concentration
sanguine en hormones thyroïdiennes libres chute, la dispari-
tion du feed-back négatif entraîne alors une augmentation de
la synthèse de la TSH hypophysaire.
Aspects cliniques
L’hypothyroïdie s’observe chez les chiens d’âge moyen ou
âgés, même si, chez certaines races prédisposées, les signes
cliniques peuvent apparaître plus tôt. Le sexe ou la castration/
stérilisation n’ont aucune influence sur le développement de
la maladie. Dans la plupart des cas, la maladie se manifeste
chez des chiens de races de taille moyenne ou grande.
D'après les publications anglo-saxones, certaines races, telles
que les Golden et les Labrador retrievers ou encore les Dober-
mans seraient prédisposées (Scott-Moncrieff 2015). Toutefois,
cette prédisposition raciale n’a pas pu être mise en évidence chez
les patients reçus à l’université de Zurich (Boretti et al. 2003).
L’hypothyroïdie se manifeste cliniquement par des symptômes
variés qui reflètent aussi bien les divers effets des hormones
thyroïdiennes sur le métabolisme général que leur influence
sur de nombreux systèmes organiques. En premier lieu, elle
engendre des troubles métaboliques (léthargie, prise de poids,
intolérance à l’effort, intolérance au froid). Environ 80 % des
patients présentent en plus des problèmes dermatologiques
(modification de structure ou de couleur du pelage, alopécie,
hypertrichose, séborrhée, otite externe,…). Du fait de l’évolution
lente de la maladie, bien souvent ces changements ne sont
perçus que tardivement par les propriétaires qui les attribuent
aux processus physiologiques accompagnant le vieillissement
de l’animal.
Des symptômes neurologiques peuvent sporadiquement se
développer soit isolément soit associés aux autres symptômes
d’hypothyroïdie (Cizinauskas et al. 2000).
L’atteinte peut porter aussi bien sur le système nerveux péri-
phérique (neuropathie périphérique avec parésie ou paralysie,
syndrome vestibulaire périphérique, parésie faciale, méga-œso-
phage) que sur le système nerveux central (myxœdème et coma
myxœdémateux, crise épileptiforme). Le lien direct de cause à
effet entre la neuropathie périphérique et l’hypothyroïdie fait, à
l’heure actuelle, l’objet d’un débat intense car aucune neuropathie
périphérique n’a pu être reproduite sur un modèle expérimental
d’hypothyroïdie (Rossmeisl 2010). D’autre part, plusieurs publi-
cations de cas ont mis en évidence la disparition des déficits
TRH
TSH
Modifié d’après : Manual of Small Animal Endocrinology 1998
Hypothalamus
Hypophyse
Thyroïde
Circulation sanguine
Tissus
T3
T3T3
T3
T3
Protéine
T4
T4T4
T4
T4
Protéine T4
libre
T4
libre
T4
libre
T3
libre
T3
libre T3
libre
–

neurologiques après l’administration de T4 (Scott-Moncrieff 2015).
Une myopathie subclinique, caractérisée par l’augmentation
de la CK, de l’ASAT et de la LDH, est par contre décrite dans
de nombreux cas d’hypothyroïdie canine. Il est probable
qu’elle contribue à l’intolérance à l’effort des chiens hypothy-
roïdiens. Des symptômes digestifs, cardiaques et oculaires
sont peu fréquemment observés. Les chiennes hypothyroï-
diennes peuvent également présenter des troubles de la
fertilité (Panciera et al. 2012).
Diagnostic
Modification des paramètres hématologiques et
biochimiques chez les chiens hypothyroïdiens
Le plus souvent une hypercholestérolémie et une hypertrigly-
céridémie marquées sont observées chez les chiens à jeun
(Boretti et al. 2003, Mooney et al. 2012).
La glycémie est normale, mais ce n'est pas le cas de la fruc-
tosamine (si mesurée), pour laquelle les valeurs sont élevées,
souvent situées à la limite supérieure ou au-delà de l’intervalle
de référence. Cela s’explique par le ralentissement du méta-
bolisme de la fructosamine chez les chiens hypothyroïdiens
(Reusch et al. 2002).
Entre 50 % et 70 % des chiens hypothyroïdiens présentent une
anémie arégénérative légère, parfois modérée. Sur les frottis, il
n’est pas rare de mettre en évidence des leptocytes (Panciera
2001).
• Triglycérides Û (50 – 88 %)
• Cholestérol Û (70 – 80 %)
• Fructosamine Û (~ 70 %)
• Légère anémie arégénérative (50 – 70 %)
• CK Û (30 – 35 %)
• Enzymes hépatiques Û (~ 30 %)
Panciera 2001, Boretti et al. 2003, Mooney 2012, Scott-Moncrieff 2015
Exploration de la fonction thyroïdienne
Avant de mesurer les hormones thyroïdiennes et la TSH
canine (cTSH) il est essentiel :
• d’exclure une maladie non thyroïdiennes (NTI) et
• de vérifier rigoureusement les médicaments que l’animal a
reçu car bon nombre d’entre eux influent directement sur les
concentrations en hormones thyroïdiennes et en TSH.
En particulier, les sulfamides peuvent conduire à un tableau
clinique et biologique d’hypothyroïdie. Lors d’expériences
menées chez l’animal (Williamson et al. 2002), il a pu être
démontré que les sulfamides freinaient la thyroïde-peroxydase
et engendraient réellement une réduction de la synthèse des
hormones thyroïdiennes avec comme résultat une chute de la
concentration en T4 totale et une augmentation compensatrice
de la synthèse et de la sécrétion de TSH.
T4 totale
La T4 totale correspond à l’ensemble d'une fraction libre (T4 libre)
et d'une fraction liée aux protéines. Le dosage de la T4 totale
mesure ces deux fractions. La synthèse de la T4 de l’orga-
nisme a lieu exclusivement au sein de la thyroïde, contraire-
ment à celle de la T3. Comme très peu de chiens hypothyroï-
diens ont une valeur de la T4 totale comprise dans l’intervalle
de référence, la mesure de ce paramètre est donc particu-
lièrement judicieuse pour exclure une hypothyroïdie (haute
sensibilité) (Scott-Moncrieff 2015).
Facteurs Influence
sur la T4
totale
Influence
sur la T4 libre
Influence
sur la TSH
Âge : < 3 mois
> 6 ans
Û
Ü
Poids : < 10 kg
> 30 kg
Û
Ü
Race : (par ex Lévrier) Ü Ü
Obésité Û
Jeûne Ü=
Efforts corporels intenses Û=Ü
Gestation (progestérone) Û
Carprofène Ü= ou ÜÜ
Aspirine Ü= ou Ü=
Glucocorticoïdes Ü= ou Ü= ou Ü
Furosémide Ü
Méthimazole Ü Ü Û
Phénobarbital = ou Ü= ou Ü= ou Û
Phénylbutazone Ü
Sulfamides Ü Ü Û
Complémentation en iode Ü Ü Û
Auto-anticorps anti-T4Û ou Ü
selon le
test utilisé
vT4 libre (Immu-
noassay) : Û
T4 libre
(par dialyse à
l’équilibre) : au-
cune influence
seulement
si en même
temps
suffrant d'hy-
pothyroïdie
Facteurs influençant les valeurs basales de la T4 totale,
de la T4 libre et de la TSH
Williamson et al. 2002, Daminet et al. 2003, Scott-Moncrieff 2015
Toutefois les valeurs de la T4 totale situées en dessous de l’inter-
valle de référence ne permettent pas de confirmer une hypo-
thyroïdie (faible spécificité du dosage), car beaucoup d’autres
causes peuvent influencer vers le bas la concentration en T4,
comme les fluctuations naturelles, l’âge, la race, les maladies
(quasiment toutes) ainsi que de nombreux médicaments. Même
l’administration topique de corticoïdes peut provoquer à court
terme une chute de la T4 totale (Gottschalk et al. 2011).
La présence d’auto-anticorps anti-T4 totale peut donner des
valeurs faussement élevées ou faussement basses de la T4
totale selon la méthode de dosage utilisée. En particulier les

valeurs faussement élevées peuvent amener à passer à côté
d'une hypothyroïdie. En effet, en raison de l’interférence dans
une analyse, les valeurs de la T4 totale vont se trouver dans
l’intervalle de référence voire au-delà.
Heureusement, seuls 8 % des chiens hypothyroïdiens ont des
auto-anticorps anti-T4. Ils sont donc bien plus rares que les
auto-anticorps anti-T3 (28 % des cas) (Graham et al. 2007). De
plus, il semblerait que l'influence des auto-anticorps anti-T4 sur
la valeur de la T4 mesurée soit rarement cliniquement significa-
tive (Pichotta et al. 2010).
Si une valeur élevée de la T4 totale est mesurée chez un chien
ne présentant aucun symptôme clinique d’hypothyroïdie, il est
impératif de se renseigner sur son régime alimentaire. Il est
fréquent qu’il se produise une élévation de la T4 totale lors de
régime à base d’aliments crus contenant des abats avec des
restes de trachée et d’œsophage (Köhler et al. 2012).
T4 libre
La T4 libre est la fraction de la T4 totale non liée aux protéines
plasmatiques. Elle est métaboliquement active et responsable du
feed-back négatif agissant sur la sécrétion hypophysaire de TSH.
Comme la T4 libre représente la forme biologiquement active
de la T4, beaucoup d’espoirs ont été placés dans la détermi-
nation de sa valeur. Cependant la concentration en T4 libre
peut également être influencée par l’administration de médica-
ments ou la présence de maladies non thyroïdiennes, toutefois
à un moindre degré par rapport à la T4 totale.
Deux méthodes de mesure, s’appuyant sur différents prin-
cipes, permettent de déterminer sa concentration :
L’immunodosage avec traceur analogue
La méthode de dosage de la T4 libre, spécifiquement vétéri-
naire, proposée par le laboratoire IDEXX donne des résultats
très comparables à ceux obtenus par la méthode de dosage
de la T4 libre par dialyse à l’équilibre (Scott-Moncrieff 2014).
Ce n’est que lorsqu’il existe des auto-anticorps anti-T4 que
la méthode de dialyse à l’équilibre est supérieure à celle de
l’immunodosage spécifiquement vétérinaire de la T4 libre car
il n’y a pas d’interférence dans ce cas. Les autres méthodes
d’immunodosage adaptées à l’homme ne devraient pas en
principe être utilisées (Scott-Moncrieff 2014).
Le dosage par dialyse à l’équilibre
Lors de dialyse à l’équilibre, la T4 liée aux protéines est rete-
nue par une membrane semi-perméable qui laisse passer la
T4 libre dans le dialysat. Celle-ci est ensuite mesurée par ra-
dio-immunologie. La détermination de la T4 libre par dialyse à
l’équilibre doit être conseillée en cas de suspicion d’auto-anti-
corps anti-T4, car seul ce procédé permet d’obtenir un résultat
correct de la concentration en T4-libre (Scott-Moncrieff 2014).
TSH canine (cTSH)
La diminution des hormones thyroïdiennes circulantes entraîne
une suppression du mécanisme de feed-back négatif et, de ce
fait, une augmentation de la sécrétion de la TSH hypophysaire.
Lorsque les commémoratifs et les symptômes cliniques
sont compatibles, l’association baisse de la T4 totale et
augmentation de la TSH suffit largement dans beaucoup
de cas à établir le diagnostic d’hypothyroïdie.
Toutefois, malheureusement, environ 30 % des chiens hy-
pothyroïdiens ne présentent pas d’augmentation de la TSH
(Scott-Moncrieff 2014).
À l’heure actuelle certaines publications ont souligné la pos-
sibilité d'un développement d’une hypothyroïdie secondaire,
liée à une baisse de la synthèse et de la sécrétion de TSH,
un mécanisme probablement sous-estimé (Scott-Moncrieff
2015). En outre, il serait probable que les dosages de la
TSH, du fait de leur haute spécificité, ne détectent pas tous
les isomères de la TSH (Boretti et al. 2015). D’autres explica-
tions possibles pointent vers l’existence de fluctuations de la
sécrétion de TSH, un épuisement des réserves hypophysaires
suite à une hypothyroïdie de longue durée (Diaz- Espineira
et al. 2008) ou encore un myxœdème hypophysaire (D. C
Ferguson 2007). D’autre part, la TSH peut aussi être augmen-
tée sans qu’il n’existe d’hypothyroïdie clinique significative,
par exemple lors de convalescence suite à une maladie non
thyroïdienne, d’hypothyroïdie subclinique (T4 totale et T4 libre
par dialyse à l’équilibre dans l’intervalle de référence, TSH ↑)
ou de l’administration de certains médicaments comme les
sulfamides ou le trilostane (Williamson et al. 2002, Boretti et
al. 2015).
T3
La T3 n’est synthétisée qu’en très faible quantité au sein de la
thyroïde, la majeure partie étant formée par désiodation de la
T4 dans les cellules cibles.
Lorsque la synthèse de T4 diminue, il se produit souvent par
compensation une augmentation de la conversion de T4 en
T3 (forme plus active d'un point de vue hormonale, et dont les
effets sont plus rapides). Ainsi, lors d’hypothyroïdie canine, il
n’est pas rare que la concentration en T3 se trouve dans l’inter-
valle de référence. De ce fait, la détermination de la valeur de T3
a peu d’intérêt pour le diagnostic d’hypothyroïdie.
Anticorps anti-thyroglobuline (Ac anti-TG)
Lors de thyroïdite lymphocytaire, il est fréquent de mettre
en évidence des anticorps anti-thyroglobuline, ce qui donne
une idée du processus pathologique ayant lieu au sein de la
glande thyroïde.
Ces anticorps ne permettent pas de prouver la présence d’un
trouble fonctionnel thyroïdien car ils sont également retrouvés
chez des chiens euthyroïdiens. D’un autre côté, ils ne sont
pas décelables lors de thyroïdite en phase terminale ou lors
d’atrophie idiopathique de la thyroïde.
Ainsi tout comme l’absence d’anticorps anti-TG ne permet
pas d’exclure une hypothyroïdie, leur détection (test positif)
n’est pas pathognomonique d’une hypothyroïdie. Lors
d'une étude, il a été démontré qu’environ 20 % des chiens
ayant des anticorps anti-TG décelables, développaient au
cours de l’année une hypothyroïdie mais, parallèlement,
sur ce même laps de temps, la détection des anticorps

anti-TG redevenait négative chez environ 15 % des patients
(Graham et al. 2007).
Une augmentation de la concentration en anticorps anti-TG
peut indiquer une thyroïdite lymphocytaire débutante. En
outre, il a pu être démontré que 95 % des chiens présentant
des auto-anticorps anti-T4 avaient également des anticorps
anti-TG (Graham et al. 2007).
Leur détermination concomitante peut contribuer à clarifier
l’étiologie ou représenter un examen de « seconde intention »
pour étayer le diagnostic d’hypothyroïdie. Des faux-positifs
sont possibles, en particulier peu de temps après une vacci-
nation ou une infection virale.
Test de stimulation à la TSH
Le test de stimulation à la TSH repose sur le principe que l’ad-
ministration d’une dose supraphysiologique de TSH doit en-
traîner une stimulation maximale de la thyroïde ce qui permet
d’estimer ses capacités de réserve hormonale. Comme la TSH
bovine n’est plus disponible sous forme médicamenteuse, il
est nécessaire d'employer la TSH recombinante humaine. Un
groupe de travail de Zurich (Boretti et al. 2009) a montré que
l’administration d’une dose bien supérieure (150 µg/chien) à
celle préconisée jusqu’à présent, permettait de différencier
correctement l’hypothyroïdie réelle d’une maladie non thyroï-
dienne chez bien plus de patients.
Réalisation du test :
• Prise de sang pour déterminer la concentration basale de T4
• Administration (IM ou IV) de 150 µg de rhTSH
• Prise de sang 6 h plus tard pour déterminer la concentration
en T4
Interprétation :
T4 post-TSH :
<19,3 nmol/l (1,5 µg/dl) : résultat en faveur d’une hypothyroï-
die
T4 post TSH :
>32,2 nmol/l (2,5 µg/dl) avec une augmentation d’au moins 1,5
fois le taux basal : résultat en faveur d’une stimulation suffisante.
Traitement
Le traitement consiste en l’administration orale quotidienne de
L-thyroxine synthétique (lévothyroxine). La posologie est com-
prise entre 10 et 20 µg/kg une ou deux fois par jour selon les
données du fabricant. La posologie initiale recommandée par
"Consensus Statement" (1996) est de 20 µg/kg de lévothyroxine
deux fois par jour.
La biodisponibilité, comprise entre 10 % et 50 %, varie fortement
selon l’individu, et dépend du moment du repas. Par consé-
quent, dans la mesure du possible, les comprimés doivent tou-
jours être donnés soit avant soit après le repas (Scott-Moncrieff
2014). La posologie initiale ne doit pas dépasser les 800 µg/
chien. Chez les patients présentant une insuffisance cardiaque
ou souffrant d’une affection concomitante rénale ou hépatique, la
posologie initiale doit être réduite de moitié ou de trois quart puis
augmentée progressivement (Scott-Moncrieff 2015).
Contrôle du traitement
En fonction des signes cliniques et de la concentration
sanguine en T4 totale, le premier contrôle aura lieu 4 à 8 se-
maines après la mise en place du traitement. Presque tous
les patients présentent, après cet intervalle de temps, une
augmentation nette de leur capacité à l’effort ainsi qu’une
normalisation des paramètres biochimiques sanguins qui
étaient modifiés (Scott-Moncrieff 2015).
Pour vérifier si la posologie de lévothyroxine est adaptée, une
prise de sang est effectuée 4 à 6 heures après l’administration
du comprimé pour déterminer le taux de T4 totale. Le but est
d’obtenir une valeur de la T4 totale dans la limite supérieure
de l’intervalle de référence ou légèrement au-delà de celui-ci
(Scott-Moncrieff 2015). Cet objectif est donné à titre indicatif.
La posologie définitive doit être ajustée individuellement en
prenant en compte la récupération clinique liée au traitement
ainsi que d’autres situations individuelles comme la présence
de maladies concomitantes ou l’administration d’autres médi-
caments (Scott-Moncrieff 2014).
Si la TSH était également élevée au moment du diagnostic,
il est judicieux de mesurer parallèlement ce paramètre. Lors
de complémentation hormonale suffisante, la concentration
en TSH doit se normaliser. Étant donné que la sensibilité
diagnostique des dosages de la TSH ne permet pas de
mesurer correctement les concentrations très faibles en TSH,
il est impossible de mettre en évidence une complémentation
hormonale excessive par la mesure de la TSH. Lorsque la
lévothyroxine n’est administrée qu’une seule fois par jour, le
prélèvement permettant de mesurer la T4 totale et la TSH doit
avoir lieu immédiatement avant la prise du comprimé suivant.
Dans ce cas, la concentration en T4 totale doit être comprise
dans l’intervalle de référence (Scott-Moncrieff 2015).
S’il est nécessaire d’ajuster la posologie, un nouveau
contrôle thérapeutique doit être prévu 4 à 8 semaines plus
tard.
Chez les patients présentant des auto-anticorps anti-T4, il
est essentiel, lors du suivi du traitement, de mesurer la T4
libre par dialyse à l’équilibre du fait du risque d'une interfé-
rence dans une analyse.
Si le diagnostic d’hypothyroïdie a été correctement établi, qua-
si tous les symptômes disparaissent avec un traitement adap-
té. Dès la première semaine de traitement, l’animal présente
une augmentation de son activité et un changement de son
comportement. La normalisation des différents paramètres de
laboratoire (par ex. l’hypercholestérolémie) s’observe au bout
de 2 à 4 semaines. En revanche, l’amélioration des lésions
cutanées et neurologiques requiert davantage de temps, entre
3 et 4 mois (Scott-Moncrieff 2015).
La persistance du tableau clinique malgré l’administration
du traitement sur une durée suffisante, doit amener le clini-
cien à reconsidérer le diagnostic d’hypothyroïdie.
Dr. Vet. Elke Huisinga
Spécialiste des animaux de compagnie
Responsable grands comptes, Laboratoire IDEXX
 6
6
1
/
6
100%