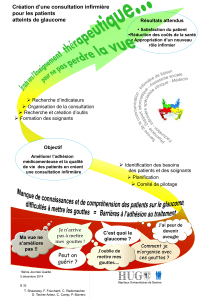
TP3 physique appliquée tests chimiques

Auteur : Béatrice DUBESSY Académie de LYON
FICHE 1 PRÉSENTATION
Titre
Tests chimiques d’identification des groupes caractéristiques en chimie
organique
Type d'activité
Travaux pratiques
Objectifs de
l’activité
Faire réaliser aux élèves des tests chimiques classiques d’identification des
fonctions chimiques
Références par
rapport au
programme
Cette activité illustre le thème vêtement et revêtement
et le sous thème Matériaux polymères
en classe de 1ère STL, programme de physique-chimie, enseignement
obligatoire commun
Notions et contenus
Squelettes carbonés et groupes
caractéristiques
Compétences attendues
Reconnaître des fonctions
caractéristiques en chimie
organique
Conditions de
mise en œuvre
Prérequis : aucun
Durée : 45 minutes
Contraintes matérielles : disposer d’un laboratoire équipé de verrerie courante.
Remarques
Auteur
Béatrice DUBESSY
Académie de LYON

Auteur : Béatrice DUBESSY Académie de LYON
FICHE 2 LISTE DU MATÉRIEL
TITRE DE L’ACTIVITÉ
Tests chimiques d’identification des groupes caractéristiques en
chimie organique
Le matériel nécessaire aux manipulations disposé sur la paillasse du professeur.
Pour 7 binômes
20 mL de solution hydroalcoolique de 2,4-dinitrophénylhydrazine (ou 2,4-DNPH)
acidifiée par de l’acide sulfurique concentré en flacon compte gouttes (préparation de
la solution : dissoudre 3 g de 2,4-DNPH dans 15 mL d’acide sulfurique concentré ;
ajouter cette solution, en agitant, à un mélange de 20 mL d’eau et 70 mµL d’éthanol)
20 mL de réactif de Tollens en flacon compte gouttes (préparation : à 1 mL d’une
solution à 10 % en masse de nitrate d’argent, ajouter 1 mL d’une solution à 10 %
d’hydroxyde de sodium. Additionner goutte à goutte, en agitant, une solution
d’ammoniac (6mol.L-1) jusqu’à dissolution du précipité).
Acide nitrique dilué (pour le décapage des tubes à essais)
20 mL de liqueur de Fehling en flacon compte gouttes
80 mL de réactif de Lucas (préparation : dissoudre 136 g de chlorure de zinc dans 105
g d’acide chlorhydrique concentré ; refroidir à température ambiante)
20 mL d’une solution aqueuse de chlorure de fer (III) à 5 % massique, en flacon
compte goutte
Quelques grammes de benzaldéhyde
10 mL d’isopropanol en flacon compte gouttes
Quelques grammes de paracétamol
Remarque : si le nombre total de compte gouttes disponibles le permet, plutôt
répartir les solutions précédentes sur les paillasses élèves.
Le matériel nécessaire aux manipulations disposé sur la paillasse des élèves.
Par binôme :
1 portoir de tubes à essais complet (avec bouchons)
Système de chauffage de tube à essais
Ethanol (en pissette si possible)
Propanone (en pissette si possible)

Auteur : Béatrice DUBESSY Académie de LYON
FICHE 3 FICHE POUR LE PROFESSEUR
TITRE DE L’ACTIVITÉ
Tests chimiques d’identification des groupes caractéristiques en
chimie organique
Objectifs :
Faire mettre en œuvre aux élèves des tests chimiques d’identification de groupements
fonctionnels.
Les protocoles sont décrits dans la fiche élève. Vous trouverez ici l’interprétation des tests
proposés et quelques compléments.
Concernant les tests réalisés par les élèves…
Aldéhydes et cétones
Test à la 2,4-DNPH (ou 2,4-dinitrophénylhydrazine) : les tests réalisés doivent être positifs avec la propanone et le
benzaldéhyde, mais négatif avec l’éthanol.
Interprétation : les cétones et les aldéhydes réagissent avec la 2,4-DNPH pour former une hydrazone solide. Le
composé cristallisé formé peut éventuellement être récupéré par filtration sous vide ; sa température de fusion
(déterminée au banc Köfler par exemple) peut permettre, à l’aide de tables, d’identifier complètement le composé
testé.
Aldéhydes
Test au réactif de Tollens (ou miroir d’argent) : ou Test à la liqueur de Fehling : ils doivent être positifs avec le
benzaldéhyde et négatif avec la propanone et l’éthanol.
Sécurité : attention aux projections éventuelles lors du chauffage du test à la liqueur de Fehling…
Les tests au réactif de Tollens et à la liqueur de Fehling impliquent les propriétés réductrices des aldéhydes. Le test
au réactif de Tollens, plus coûteux et souvent plus délicat à mettre en œuvre, est un peu moins utilisé que celui à la
liqueur de Fehling.
Ces tests sont très utiles pour distinguer les cétones des aldéhydes (qui réagissent tous deux avec la 2,4-DNPH)
Alcools
Test de Lucas (caractéristique de la classe de l’alcool) : le résultat doit être positif avec l’isopropanol et négatif avec
l’éthanol.. qui est pourtant un alcool aussi ! Le test permet donc de ne mettre en évidence que des alcools secondaires
ou tertiaires.
Interprétation : lors de ce test, la fonction hydroxyle est substituée par un halogène. La réaction est d’autant plus
facile que le degré de substitution du carbone portant l’hydroxyle est élevé, soit plus facile avec un carbone tertiaire,
que secondaire. Elle ne se produit pas avec un carbone primaire.
Phénol
Test au chlorure de fer (III) : le test doit être positif avec le paracétamol et négatif avec le benzaldéhyde et l’éthanol.
La coloration violette est due à la formation d’un ion complexe entre les ions fer (III) et le phénol. Classiquement, ce
test est réalisé en solution dans le chloroforme, solvant volatil et cancérigène…

Auteur : Béatrice DUBESSY Académie de LYON
Autres tests chimiques classiques utilisés en chimie organique, non proposés ici à la
manipulation des élèves (notamment pour des raisons de sécurité, compte tenu de la toxicité de
certains composés à utiliser).
Amines
Test de Hinsberg (caractéristique de la classe de l’amine) : à quelques gouttes ou quelques grains d’amine à tester,
ajouter une dizaine de gouttes de chlorure de benzènesulfonyle et 1 mL d’eau.
Conclusions :
- si un précipité soluble en milieu basique se forme (ajouter pour cela une solution d’hydroxyde de sodium à
10 %), l’amine est probablement primaire
- si un précipité insoluble en milieu basique se forme (ajouter pour cela une solution d’hydroxyde de sodium
à 10 %), l’amine est probablement secondaire
- si rien ne se passe, l’amine est probablement tertiaire.
Interprétation : le test se fait en deux temps. Tout d’abord, l’amine est soumise au chlorure de benzène sulfonyle.
Seules les amines primaire et secondaire réagissent pour former des sulfamides. La solubilité, en milieu basique, des
sulfamides formés permet ensuite de connaître la classe (primaire ou secondaire) de l’amine.
Comme pour le test de Lucas, ce test ne permet finalement pas de caractériser une amine primaire (sauf si l’in est au
préalable certain que le composé contient une fonction amine).
Esters, nitriles et amides
Dans 1 mL de solution éthanolique d’hydroxylammonium, dissoudre 2 gouttes ou quelques grains d’échantillon.
Ajouter 4 gouttes d’une solution à 20 % d’hydroxyde de sodium. Chauffer près du point d’ébullition environ 2
minutes. Refroidir à température ambiante, puis ajouter 2 mL d’acide chlorhydrique 1mol.L-1 et, si une turbidité
apparaît, 2 mL d’éthanol à 95 %. Ajouter ensuite goutte à goutte une solution aqueuse de chlorure de fer (III) à 5 %
en agitant.
Conclusion : si une coloration violette apparaît, alors le composé contient une fonction ester, amide, nitrile ou un
groupement phénolique. Réaliser alors le test au chlorure de fer(III) pour savoir s’il s’agit éventuellement de
groupements phénoliques (qui pourraient alors masquer des fonctions ester, amide ou nitrile).
Alcènes
Test au dibrome : à une solution de l’échantillon dans du dichlorométhane (ou chloroforme si nécessaire),
additionner goutte à goutte une solution à 5 % de brome dans le tétrachlorométhane.
Conclusion : si les premières gouttes de solution de dibrome sont décolorées au contact de la solution à analyser, puis
que la coloration persiste, alors le composé est insaturé.
Interprétation : le dibrome s’additionne sur la double liaison de l’alcène pour former un dérivé dibromé.
Halogénoalcanes
A 2 mL d’une solution éthanolique de nitrate d’argent, ajouter quelques gouttes ou quelques grains d’échantillon. Si
rien n’apparaît au bout de trois minutes, chauffer le mélange.
Conclusions :
- si un précipité apparaît sans chauffer en moins de deux minutes et ne se dissout pas dans l’acide nitrique,
alors le composé peut être un bromure ou un iodure d’alkyle, ou un chlorure d’alkyle tertiaire.
- si un précipité apparaît après chauffage et ne se dissout pas dans l’acide nitrique (ajouté à froid !), alors le
composé peut être un chlorure d’alkyle primaire ou secondaire.
- si un précipité apparaît et se dissout dans l’acide nitrique, il peut alors s’agir d’un acide carboxylique.
Interprétation : les précipités obtenus sont des précipités d’halogénure d’argent. Ils apparaissent d’autant plus
facilement que le composé à tester contient une liaison carbone-halogène facile à rompre, ce qui dépend à la fois du
type d’halogène et de la nature du carbone lié à cet halogène.

Auteur : Béatrice DUBESSY Académie de LYON
Remarque : actuellement, ces tests chimiques sont supplantés par les techniques de
caractérisation spectroscopiques (infra-rouge, ultra-violet, RMN, …) des composés. Ces
nouvelles techniques permettent bien souvent d’établir la structure complète des molécules,
ce que ne permettent que très rarement les tests chimiques. Ces derniers restent cependant
très pratiques et faciles à mettre en œuvre pour des caractérisations rapides.
Bibliographie :
M. Chavanne, A. Jullien, G.J. Beaudoin, E. Flamand, Chimie organique expérimentale, 2° ed,
Belin, 1991.
Cahier de laboratoire : analyse fonctionnelle et qualitative.
 6
6
 7
7
1
/
7
100%