CONTROLE DE CHIMIE N°2

CONTROLE DE CHIMIE
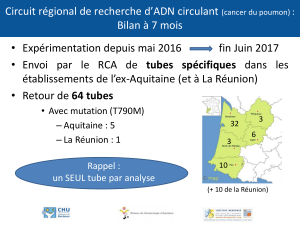
Exercice n°1
On dissout 5 g de chlorure de potassium (KCl) dans 25 mL d’eau
1°)Nommez le solvant et le soluté
2°)Calculez la concentration massique de KCl
3°)Calculez la masse molaire de KCl
4°)Calculez le nombre de mol de KCl en solution puis la concentration molaire de KCl
On donne :MK=39g/mol et MCl=35,5g/mol)
Exercice n°2
On plonge une barre de métal M dans une solution contenant des ions de métal M’
1)Dans les expériences suivantes, indiquer s il y a réaction chimique.
2) Ecrire la réaction chimique traduisant le dépôt de métal sur la barre (dans le cas où il y a dépôt)
Exercice n°3
Des pièces métalliques destinées à l’industrie chimique peuvent être réalisées parmi deux métaux :
le cuivre ou le fer
1)Les pièces sont mises en contact de solutions acides (ion H+).A partir de la classification
électrochimique ,expliquez quel est le métal qu’on devrait choisir ?
2)Pour des raisons de coût ,on choisit finalement le fer.
Il se produit une réaction d’oxydoréduction

a) Déterminez les couples oxydant réducteur en présence ,nommez dans chaque cas
l’oxydant et le réducteur
b) Equilibrer l’équation bilan de cette réaction
Fe + H30+ Fe2+ + H2 + H20
3) Comment peut on faire pour protéger le fer ?
Exercice 4 :
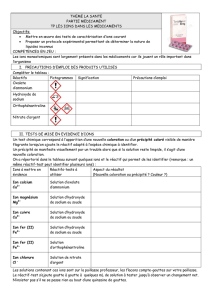
On dispose de quatre tubes à essais contenant des solutions ioniques différentes .Ces tubes nommés
A,B,C,et D ont été intervertis avant d’être étiquetés .Le but des expériences suivantes est de
retrouver la solution ionique d’origine ,présente dans les tubes correspondants .
Les quatre composés ioniques sont
CuCl2
CuSO4
AlCl3
FeSO4
1) Pour chacun des composées ioniques, donner les ions présents en solution en complétant le
tableau suivant
Composé
ionique
Ions présents
Anions
Cations
CuCl2
CuSO4
AlCl3
FeSO4
2)Détermination ,des solutions :
On identifie les ions en solution à l’aide des réactifs donnés dans les tableaux suivants :

Ion
Chlorure Cl-
Sulfate SO42-
Réactif
Nitrate d’Ag
AgNO3
Chlorure de
Baryum
BaCl2
Précipité obtenu
Blanc
Blanc
Ion
Al3+
Fe2+
Zn2+
Cu2+
Réactif
soude
soude
soude
soude
Précipité obtenu
blanc
vert
blanc
bleu
On désire tester les solutions des tubes A,B,C,D avec chaque réactif. On répartit le contenu du tube
A dans trois tubes à essais .On fait de même avec les tubes B,C,D.Les résultats des expériences
sont donnés dans le tableau suivant :
Tube réactifs
A
B
C
D
Nitrate d’Ag
Précipité Blanc
Précipité Blanc
X
X
Chlorure de
Baryum
X
X
Précipité Blanc
Précipité Blanc
Soude
Précipité Blanc
Précipité Bleu
Précipité Bleu
Précipité Bleu
Solution
Identifier en argumentant les solutions
On donne :
n=
m
M
Conc molaire :[A]=
n
V
Conc massique :Cm=
m
V
1
/
3
100%