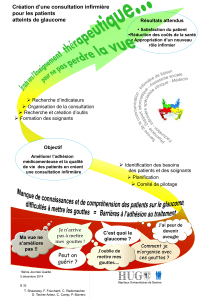
Résumé des Caractéristiques du Produit 1

Résumé des Caractéristiques du Produit 06/2015-RCP-FR
1. DENOMINATION DU MEDICAMENT
Urgenin Gouttes
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Solution à base de plantes.
Pour 100 g d'Urgenin Gouttes
Teinture de Serenoa repens (Bartram – Small) (1/10) 65 g
Jus d'Echinacea purpurea (Moench) (80/20) 27,92 g.
Excipient à effet notoire : éthanol
La solution finale contient 46 volume % d’éthanol, soit 0,570 ml d'éthanol par dose.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Gouttes à usage oral
4. DONNEES CLINIQUES
4.1 Indications thérapeutiques
Urgenin Gouttes, à base de plantes, est proposé comme adjuvant dans les troubles de la miction liés
à une hypertrophie prostatique bénigne après que toute pathologie sévère ait été écartée.
Chez la femme, Urgenin Gouttes, à base de plantes, est proposé comme traitement adjuvant en cas
de cystalgie et d’instabilité vésicale, après que toute pathologie sévère ait été écartée.
4.2 Posologie et mode d’administration
25 gouttes dans un peu d’eau à prendre trois fois par jour, pendant les repas.
Ne pas utiliser pendant plus de 14 jours sans amélioration considérable.
Un léger trouble peut être observé, ceci n’altère pas la qualité du produit.
Agiter le flacon avant l’emploi.
Il n’y a pas de patients à risque qui demandent une adaptation de la dose.
4.3 Contre-indications
−Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1
−Une hypersensibilité à un des composants, des allergies atopiques.
−Le cancer de la prostate est une contre-indication.
−Urgenin Gouttes n’est pas destiné aux enfants.
−Ne pas utiliser Urgenin Gouttes si vous souffrez d’une affection allergique.
4.4 Mises en garde spéciales et précautions d’emploi

Résumé des Caractéristiques du Produit 06/2015-RCP-FR
Ce médicament contient 46 % de vol d'éthanol (alcool), c.-à-d. jusqu’ à 456 mg par dose, ce qui
équivaut à 11,4 ml de bière, 4,8 ml de vin par dose. Nocif pour les patients alcooliques.
A prendre en compte chez les femmes enceintes ou allaitant, les enfants et les groupes à haut risque
tels que les insuffisants hépatiques ou les épileptiques.
Avant d’instaurer un traitement avec Urgenin Gouttes, il est nécessaire que soit évalué le caractère
bénin ou malin de la pathologie. L'hypertrophie prostatique nécessite un contrôle médical régulier.
L’alcoolisme constitue une contre-indication relative.
4.5 Interactions avec d’autres médicaments et autres formes d’interaction
A ce jour aucune interaction propre aux constituants actifs n’est connue. Toutefois, étant donné qu’il
s’agit d’extraits alcooliques, un effet DISULFIRAM peut apparaître lors de l’association avec certains
médicaments.
Afin de sensibiliser le patient aux interactions possibles, il est conseillé de s’informer auprès du
patient de la prise de tout autre médicament.
4.6 Fertilité, grossesse et allaitement
Par prudence et vu le manque de données à ce sujet, Urgenin Gouttes ne sera pas administré
pendant ces périodes.
4.7 Effets sur l’aptitude à conduire des véhicules et à utiliser des machines
Aux doses prescrites, la quantité d’alcool absorbée n’influence normalement pas la capacité de
conduite ou l’utilisation de machines.
4.8 Effets indésirables
Dans de rares cas, des nausées ou gastralgies ont été mentionnées.
Dans ce cas, la prise aura lieu de préférence après le repas.
Il est conseillé au patient de mentionner tout effet inattendu à son médecin ou pharmacien pendant
la prise d’Urgenin Gouttes.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante.
Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels
de santé déclarent tout effet indésirable suspecté en Belgique via l’Agence Fédérale des
Médicaments et des Produits de Santé, Division Vigilance, EUROSTATION II, Place Victor Horta,
40/40, B-1060 Bruxelles.
Site internet: www.afmps.be.
e-mail : adversedrugreactions@fagg-afmps.be
4.9 Surdosage
En cas de surdosage, une élévation de l’alcoolémie est prévisible.
Un traitement symptomatique sera instauré.
Centre Anti-poison (070/245.245).

Résumé des Caractéristiques du Produit 06/2015-RCP-FR
5. PROPRIETES PHARMACOLOGIQUES
5.1 Propriétés pharmacodynamiques
Classe pharmacothérapeutique : médicament du système uro-génital, code ATC : G04CX
Mécanisme d’action
L’extrait éthanolique de Serenoa repens est doté de propriétés anti-androgéniques périphériques.
Effets pharmacodynamiques
Une action anti-œdémateuse a été mise en évidence chez l’animal.
L’extrait éthanolique d’Echinacea purpurea posséderait des propriétés immunomodulatrices et
stimulerait la production de fibrocytes et fibroblastes.
Efficacité clinique
Une amélioration des troubles de la miction liés à une hypertrophie prostatique benigne a été
constatée.
Une activité décongestionnante et antispasmodique sur la sphère vésicale féminine a été mise en
évidence.
5.2 Propriétés pharmacocinétiques
Aucune donnée disponible à ce jour.
5.3 Données de sécurité précliniques
Aucune selon les standards actuels.
6. DONNEES PHARMACEUTIQUES
6.1 Liste des excipients
Ethanol mélangé au jus d'Echinacea purpurea (Moench) 6,98 g
6.2 Incompatibilités
Sans objet.
6.3 Durée de conservation
2 ans
6.4 Précautions particulières de conservation
A conserver à une température ambiante, entre +15°C et +25°C, dans l’emballage d'origine.
6.5 Nature et contenu de l’emballage extérieur
Flacon de 50 ml et 100 ml.

Résumé des Caractéristiques du Produit 06/2015-RCP-FR
6.6 Précautions particulières d’élimination et manipulation
Pas d'exigences particulières.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en
vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
Meda Pharma s.a.
Chaussée de la Hulpe 166
1170 Bruxelles
8. NUMERO D’AUTORISATION DE MISE SUR LE MARCHE
BE281574
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
A. Date de première autorisation : 01/07/1966
B. Date de dernier renouvellement :16/06/2007
10. DATE DE MISE A JOUR DU TEXTE
01/2016
DATE D’APPROBATION DU TEXTE : 04/2016
1
/
4
100%