Addition nucleophile d organozinciques sur les

3
A . Formation d'alcools à partir d'halogénures aromatiques fonctionnalisés et d'aldéhydes.
La réaction de couplage direct entre un halogénure aromatique et les aldéhydes a été
décrite par Nozaki, Hiyama et Kishi1. Elle nécessite le plus souvent des quantités
stoechiométriques de sel de chrome divalent, réactif toxique, et des iodures aromatiques.
Il a été récemment montré que ce couplage pouvait être réalisé par électrosynthèse en
utilisant des quantités catalytiques de sels de chrome2. Cette dernière réaction est cependant
limitée à l'échelle du laboratoire. Afin de remédier à ces inconvénients, une méthode de couplage
direct a également été envisagée via une catalyse par un complexe du nickel [Ni(dppe)Br2] en
présence de zinc3. Cette méthode ne donne cependant que de faibles rendements lorsque
l'halogénure aromatique porte un groupement attracteur. De plus, le nickel est suspecté de
toxicité. Le recours à des organométalliques est donc apparemment nécessaire. Nous
présenterons donc dans ce rappel bibliographique les résultats concernant l'addition nucléophile
de divers organométalliques sur les aldéhydes.
1) Avec les organolithiens GF-Ph-Li4.
Les composés organolithiens jouent un rôle essentiel en tant que réactifs organométalliques pour
la synthèse organique. Les dérivés lithiens aromatiques ou hétéro-aromatiques fonctionnalisés se
préparent par un échange halogène (X=Br ou I)-Lithium. Ils ne sont stables qu'à très basse
température et peuvent être couplés avec des électrophiles divers. Leur réaction avec les dérivés
carbonylés conduit à de très bons rendements en alcools (équation 1).
Equation 1
CN
I
CN
Li R'
RO
CN
R
R'
OH
nBuLi, THF/hexane
-100 ° C
1)
2) H+
Lorsque ces lithiens aromatiques sont transformés en zinciques par réaction de
transmétallation à l'aide de sels de zinc, ils deviennent stables à 25°C et peuvent réagir avec un
certain nombre de réactifs électrophiles en présence d'un métal de transition qui joue le rôle de
catalyseur de la réaction. L'addition de ces zinciques, ainsi préparés, sur les aldéhydes n'a pas été
décrite.
2) Avec les organomagnésiens GF-Ph -MgX5.
1 L A. Wessjohann, G. Scheid Synthesis, 1999,1, 39
2 M. Durandetti, J. Y. Nédelec,1. Périchon Org.Lett., 2001, 13, 2073
3 K. K. Majumdar, C. H. Cheng Org.Lett., 2000, 15, 2295
4 A. Boudier, L. O. Bromm, M. Lotz, P. Knochel Angew Chem. Int. Ed., 2000, 39, 4414

4
Les organomagnésiens fonctionnalisés sont synthétisés avec de bons rendements
par un échange halogène (X=brome ou iode)-magnésium à basse température (équation 2).
Dans ces conditions, des groupements fonctionnels sensibles comme les esters, les nitriles
ou les imines peuvent être présents sur le noyau aromatique. Ces magnésiens peuvent être
couplés directement avec des aldéhydes (équation 2).
Equation 2
O
O
CN
OH
I
O
CN CHO
O
MgBr
O O
IPrMgBr
THF, -20°C, 1 H
THF,-20°C, 30 min
min
1)
2) H +
83 %
Le couplage entre un organomagnésien et un aldéhyde conduit donc à de très bons
rendements. Toute une gamme de réactifs de Grignard porteurs de groupements électro-
attracteurs peuvent ainsi être obtenus pour être ensuite couplés avec des aldéhydes.
Cependant, la méthode présente l'inconvénient d'opérer à basse température et de
nécessiter l'utilisation de l'organomagnésien iPrMgBr ou iPr2Mg.
3) Avec les organozinciques GF-Ph-ZnX6.
Contrairement aux organométalliques décrits précédemment, les organozinciques
aromatiques porteurs de groupements fonctionnels réactifs sont stables à température
ambiante. Cependant, l'accès à ces composés n'est pas aisé. Ils sont préparés à partir des
lithiens correspondants (par transmétallation) ou par insertion directe de zinc activé de
façon plus ou moins simple, sur les iodures ou bromures aromatiques.
L'addition nucléophile de ces composés sur les aldéhydes n'est possible qu'en présence de
CrCl3 (équation3).
Avec les aldéhydes non énolisables, les deux réactifs (RCHO et CrC13) sont
additionnés en une seule étape sur l'organozincique en présence de chlorotriméthylsilane
TMSCl (qui évite l'oxydation d'Oppenauer).
Equation 3
ZnI
GF CH--R
GF |
CrCl3, TMSCl
+ R-CHO OH
H +
5 A. E. Jensen, W. Dohle, 1. Sapountzis, D. M. Lindsay, V. A. Vu, P. Knochel Synthesis, 2002, 39, 4414
6 Y. Ogawa, A. Saiga, M. Mori, T. Shibata, K. Takagi J. Org. Chem., 2000, 65, 1031

5
En revanche, avec les aldéhydes énolisables R'CHO, il est nécessaire de traiter
préalablement le zincique aromatique avec du CrCl3 pour former l'organochrome aromatique.
L'aldéhyde est alors ajouté dans une deuxième étape (équation 4). L'alcool est ainsi obtenu
avec un bon rendement. Dans ces conditions, l'oxydation conduisant à la formation de la
cétone n'a pas lieu, et ce même en l'absence de TMSCl. Ce dernier réactif augmente
cependant le rendement.
Equation 4
ZnI
GF CH--R'
GF |
CrCl3CrCl2
GF OH
1) R'-CHO
2) H +
Les zinciques aromatiques sont donc très intéressants pour la synthèse de molécules
hautement fonctionnalisées, notamment pour le couplage de composés aromatiques porteurs
de groupements électro-attracteurs, car ni les organomagnésiens ni les lithiens ne peuvent
porter ce genre de groupement fonctionnel, à moins de travailler à très basse température.
Cependant, l'accès à ces organozinciques n'est pas facile et leur couplage avec les aldéhydes
présente l'inconvénient de devoir mettre en oeuvre du chrome, composé toxique.
B . Synthèse d’organozinciques aromatiques fonctionnalisés via une catalyse au cobalt .
Le LECSO a mis au point en 2001 une méthode purement chimique de synthèse
d’ organozinciques aromatiques fonctionnalisés à partir des bromures correspondants via une
catalyse au cobalt7.
L'halogénure de cobalt (II) est réduit en cobalt (I) par du zinc en poudre simplement
activé par des traces d'acide en milieu solvant acétonitrile. Ce cobalt (I) réagit par addition
oxydante avec le bromure aromatique pour conduire à un complexe ArCoIIIBr2. Ce dernier est
réduit par la poudre de zinc en ArCoIIBr qui réagit alors avec le Zn2+ formé dans les étapes
précédentes, par réaction de transmétallation pour conduire à l'organozincique.
7a. H.Fillon, C.Gosmini, J.Périchon, J.Am.Chem.Soc. 2003,125, 3867.70
b H.Fillon, C.Gosmini, J.Périchon, Brevet n°01/.8880 déposé en juillet 2001

6
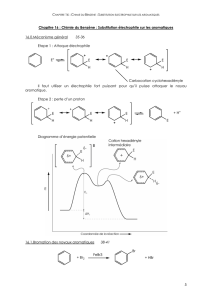
Le cycle catalytique de cette réaction est représenté sur le schéma 1.
Schéma 1
ArCoIIIBr2
H+
½ Zn
½ Zn*
(½ + ½) ZnBr2
CoBr
ArZnBr
ArCoIIBr
½ Zn*
CoIBr
ArBr
1
/
4
100%