CHIMIE

Spé PC
2011-2012
C
C
CH
H
HI
I
IM
M
MI
I
IE
E
E
Programme de colle : semaines 16 et 17
Questions de cours : 80 ( Wittig inclus), 81( avec C-alkylation), 82 (variante 2), 101, 108
Les étudiants doivent avoir une fiche avec les données de Hückel nécessaires à leur question de
cours
Rq. valable pour TOUS les programmes de colle de chimie organique : tous les chapitres de
chimie organique de sup et de spé déjà vus pourront être utilisés dans les exercices .
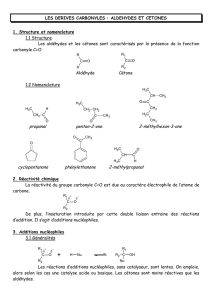
C.O.6 Aldéhydes et cétones
I"#"Préparation"par"oxydation"des"alcools"
1) Oxydation en solution aqueuse
2) Oxydation en solvant anhydre
3) Oxydation en phase vapeur
a. Oxydations catalytiques
b. Déshydrogénation catalytique
II"#"Propriétés"et"réactivité"du"groupe"carbonyle"
1) Structure
2) Description par la théorie de Hückel
(les résultats sont donnés)
3) Propriétés physiques, spectroscopies
4) Réactivité
a. A.N.
Assistance électrophile
Comparaison cétones-aldéhydes
b. Intervention du C en α du
carbonyle
III"#"Tests"caractéristiques"des"aldéhydes"et"des"
cétones""
1) Test des aldéhydes ET des cétones
2) Tests des aldéhydes (résultats
expérimentaux uniquement)
a. Liqueur de Fehling
b. Test de Tollens
c. Réactif de Schiff
IV"#""Additions"nucléophiles"
1) Allongement de la chaine carbonée
a. A.N. d’organomagnésiens
mixtes
b. La réaction de Wittig
c. Autres réactions (cyanures,
alcynures)
2) Réduction par le tétrahydruroborate de
sodium
3) Acétalisation en milieu acide ;
protection de fonction
a. Bilan
b. Mécanisme
c. Déplacement de l’équilibre
d. Utilisation en synthèse ;
protection de fonctions
(exemple)
V"–"Réactions"en"α"du"groupe"carbonyle"
1) Notion de tautomérie : équilibre céto-
énolique
a. Acidité des H portés par le C
en α du carbonyle
b. Mécanisme de formation de
l’énol
c. Proportion d’énol
2) Formation de l’ion énolate
3) Généralisation : obtention d’un
carbanion en α d’un groupe Π-
attracteur
4) Réactions de l’ion énolate
a. OF de l’ion énolate, réactivité
nucléophile
b. C-alkylation
c. Réaction d’aldolisation
d. Réactions de crotonisation
Mécanisme en milieu acide
Mécanisme en milieu basique : E1cb
VI"–"Addition"conjuguée"sur"les"α#énones"
5) Présentation
6) Action des organométalliques
e. Les RMgX
f. Les Rli (prépa.hors
programme)
g. Les R2CuLi : dialkylcuprates de
lithium
Préparation à partir des RLi
Rq .: justification de la régiosélectivité hors
programme
1
/
1
100%