TP2

TP2 : mutation au niveau d’une protéine et conséquence sur la conformation spatiale de la molécule
On cherche à expliquer le mécanisme par lequel les HbS se polymérisent en fibrilles à l’intérieur des GR.
Document 1 : les structures des protéines
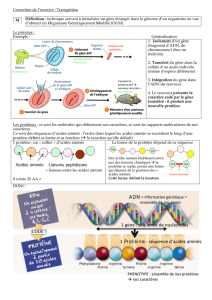
Une protéine est un polymère linéaire (collier de perles)
d’acides aminés. Il existe 20 acides aminés différents.
La nature, le nombre et l’ordre des acides aminés d’une protéine
constitue sa séquence ou structure primaire.
Chaque chaîne polypeptidique adopte spontanément dans
l’espace une conformation spatiale qui dépend de sa structure
primaire (séquence en aa).
La chaîne d’acides aminés se replie sur elle même grâce à 2
types d’interactions :
- des liaisons faibles (liaisons H, liaisons électriques..) entre des
aa de la protéine plus ou moins proches.
- des interactions entre la protéine et l’eau dans laquelle elle se
trouve (cytoplasme): les parties hydrophobes (qui n’qaiment pas
l’eau) de la protéine se situent dans sa partie centrale, à l’abri de
l’eau, alors que les parties comportant des aa hydrophiles (qui
aiment l’eau) sont localisées à la périphérie.
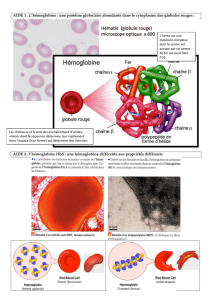
Document 2 : Séquence en acides aminés des globines alpha et béta de l’Hemoglobine normale (HbA) et de l’hémoglobine S
(HbS) responsable de la drépanocytose
3- Logiciel Rasmol à l’aide duquel vous établierez les différences de structure et de fonctionnement entre les HbA et HbS
Présentation : Ce logiciel permet de représenter en 3D la structure d’une protéine.
Les séquences en acides aminés des protéines qui vous intéressent ont été chargées dans le logiciel Rasmol dans le dossier hb-drep
Ce sont les suivantes
Nom du
fichier
Protéine
Betadrep
globine β de l’HbS ( hémoglobine mutée)
Betanorm
globine β de l’HbA (hémoglobine normale)
Hba
Tétramère constitué de 2 globines α et de 2 globines β (les 2 chaînes α de HbA sont nommées par le logiciel a et
c ; et les 2 chaînes β sont nommées par le logiciel b et d)
Hbs
Tétramère constitué de 2 globines α et de 2 globines β (les 2 chaînes α de HbS sont nommées par le logiciel a et
c ; et les 2 chaînes β sont nommées par le logiciel b et d)
hbshbs
Association de deux HbS( pour la première molécule d’HbS les 2 chaînes α sont nommées par le logiciel a et c ;
et les 2 chaînes β sont nommées par le logiciel b et d ; pour la seconde molécule d’HbS les sous unités sont e et g
et f et h)
Critères de réussite :
Saisir des
données
avec un
logiciel
comparer la conformation spatiale des globines saines et mutées
Appeler l’examinateur pour vérification
Ouvrir simultanément 2 applications
Rasmenuf
mise en évidence de l’acide aminé qui diffère
Traiter des
données
avec un
logiciel
Mettre en évidence les différents éléments constitutifs d’une
hémoglobine.
Appeler l’examinateur pour vérification
Travailler sur HbA ou HbS au choix
les chaînes identiques doivent être colorées
de la même façon, les hèmes et leur atome de
Fer doivent être mis en évidence, la
différence entre les molécules HbA et HbS
doit être soulignée.
Prévoir des
résultats
Sachant que l’acide glutamique est un aa hydrophile et que la
Valine et hydrophobe et vu le positionnement de ces aa dans la
conformation spatiale de la protéine pouvez-vous prévoir la
cause de la polymérisation ?
Elaborer une
synthèse
Mettre en évidence le rôle de l’acide aminé qui diffère dans la
polymérisation des HbS
Appeler l’examinateur pour vérification
Le dimère d’HbS doit être disposé et coloré
de façon appropriée

Documents d’aide

1
/
3
100%