SCI 10F - hrsbstaff.ednet.ns.ca

SCI 10F Révision pour l’examen de la chimie
Résultats d’apprentissages :
Faire une enquête sur des réactions chimiques lors de l’application des normes
SIMDUT en utilisant des techniques convenables pour manipuler et disposer des
matériels (213-9, 117-5)
1. L’abréviation de SIMDUT :
2. Quelles sont les trois parties de la législation de SIMDUT?
3. L’abréviation de FSSP : Indiquer 3 choses trouvé sur un FSSP :
4. Explique les symboles suivants :
Résultats d’apprentissages :
5. Étudier aussi votre page avec les règles de sécurité dans le labo de
chimie.
Résultat d’Apprentissage :
Nommer et écrire des formules de composés ioniques et moléculaires courants, et
décrire l’utilité du système de nomenclature de l’UICPA (319-1, 114-8)
6. Remplissez le tableau ci-dessous pour 4 éléments de votre choix:
Symbole
Nom
Masse
atomique
Numéro
atomique
# de
protons
#
d’électrons
# de
neutrons
7. Quelles informations les colonnes verticales du tableau périodique nous
fournissent? Quel nom est donné à ces colonnes?

8. Quelles informations les rangées du tableau périodique nous fournissent
(horizontale)? Quel nom est donné à ces rangées?
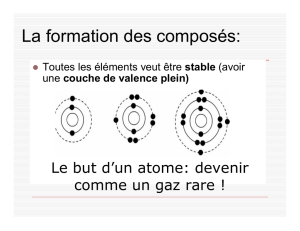
9. Dessinez un schéma de couche d’électron pour Calcium (Bohr-
Rutherford).
10.Dessinez un schéma de configuration électronique pour Phosphore
(Lewis).
11.Quelle est la couche de valence et les électrons de valence?
12.Les groupes/ familles du tableau périodique. Remplissez le tableau avec
les noms des familles qu’on a étudié et donnez les premières 5 éléments
comme exemples de chaque famille.
Groupe
Nom
Exemples
1
2
3-12
7
8
13.Quel membre du groupe 1 n’est pas actuellement un métal alcalin?
Pourquoi?
14.Dans le tableau périodique, où sont :
a. Les métaux?
b. Les non-métaux?
c. Les métalloïdes?
d. Donnez un exemple pour a, b et c.
15.Contrastez un anion et un cation.
16.Comment un atome neutre devient :
a. Un anion?
b. Un cation?
17.Donnez deux exemples d’atomes qui formeront :
a. Un anion
b. Un cation
18.Tous les atomes veulent être comme quel groupe du tableau périodique?
Comment accomplissent-ils ceci?
19.Dessinez le schéma de configuration électronique pour l’ion formé par les
atomes suivants. Donnez la charge de l’ion.
a. Lithium
b. Chlore
c. Sélénium
20.Les atomes des éléments suivants gagneront ou perdront-ils des électrons
lors de la formation des ions?
a. Azote
b. Brome
c. Magnésium
21.Donnez la définition pour et un exemple d’un compose binaire.

22.Quel type de liaison est formé entre les ions? Cette liaison produit quel
type de composé?
23.Les composés ioniques contiennent un _________________ et un
_______________________.
24.Quelles sont les 3 étapes à suivre pour noter la formule d’un composé
ionique?
25.Dessinez le schéma de configuration électronique et le schéma de couches
d’électrons pour la formation de MgF2.
26.Nommez les composés ioniques binaires ci-dessous :
a. K2O
b. NaBr
c. Cs3N
d. CaCl2
e. BaS
27.Écrivez la formule pour les composés ioniques ci-dessous (la méthode du
chassé-croisé pourrait être utile) :
a. Oxyde de sodium
b. Phosphure de baryum
c. chlorure d’aluminium
d. Sulfure de potassium
e. Nitrure d’hydrogène
28.Comment détermine-t-on un métal de transition? Quelle propriété
spécifique ont-ils?
29.Trouvez le nom pour les composés ioniques ci-dessous. La méthode du
chassé-croisé inverse pourrait être utile. Utilisez le système Stock pour
identifier la charge du métal de transition.
a. FeO
b. Cu3P
c. Pb3N2
d. CuCl2
30.Écrivez la formule pour les composés ioniques ci-dessous.
a. Nitrure de cobalt (II)
b. Oxyde de plomb (II)
c. Iodure de fer (II)
d. Chlorure d’or (III)

31.Remplis les tirets des ions polyatomiques qui manque (leurs noms et
charges). Regarder sur votre tableau périodique pour les réponses.
Acétate CH3COO-
Sulfite SO32-
Chlorite ClO2-
_________ NH4+
Chlorate ClO3-
Sulfate ________
Nitrite NO2-
Phosphite PO33-
Nitrate _________
Phosphate ________
________ CO32-
Hydroxyde ________
32.Nommez les composés suivants :
a. NaOH
b. CaCO3
c. H2SO4
d. NH4OH
e. K3PO4
f. NaNO3
33.Écrivez la formule pour les composés suivants :
a. Hydroxyde de magnésium
b. Phosphate de cadmium
c. Carbonate d’aluminium
d. Sulfite de lithium
e. Nitrite de césium
34.Qu’est-ce qu’une liaison covalente? Quel type de composé forment-elles?
35.Quelles sont les règles pour nommer les composés moléculaires?
36.Les composés moléculaires se composent d’un ____________________+
un _______________________.
37.Dessinez le schéma de configuration électronique et le schéma de couches
d’électrons pour la formation de CCl4.
38.Nommez les composés moléculaires ci-dessous.
a. P4O6
b. SF6
c. SO2
d. S3F2
39.Écrivez la formule pour les composés moléculaires ci-dessous.
a. Dioxyde de tribore
b. Triiodure d’azote
c. Heptahydrure de hexasoufre
d. Monoxyde de diazote
40.Qu’est-ce qu’une molécule diatomique? Est-elle un composé ionique ou
moléculaire?
Quels éléments existent seulement en molécules diatomiques dans
l’état gazeux?

Résultats d’apprentissages :
Représenter des réactions chimiques et la conservation de la masse au moyen d’équations symboliques
équilibrées (321-1).
41.Dans la formule 4Cu(NO3)2, combien d’atomes y a t il de :
a. Cuivre?
b. Azote?
c. Oxygène?
42.Quelle est la loi de la conservation de la masse?
43.Équilibrez les réactions suivantes – Aussi indique sur quelle coté on trouve
les réactifs d’une équation et les produits.
a. Al + H2SO4 H2 + Al2(SO4)3
b. H3PO4 + NaOH Na3PO4 + H2O
44.Comment peut-on identifier :
a. Une réaction exothermique? Donnez un exemple.
b. Une réaction endothermique? Donnez un exemple.
45.Pour les équations suivantes :
i. Identifiez le type de réaction (S, D, DS, DD, C)
ii. Équilibrez l’équation finale
a. Na2CO3 + HCl NaCl + H2CO3
b. Ca + H2O Ca(OH)2 + H2
c. C4H10 + O2 CO2 + H2O
d. NH4NO3 N2O + H2O
e. Ca + N2 Ca3N2
46.Traduisez les réactions nominatives suivantes en équations équilibrées.
Aussi, identifiez le type de réaction.
a. Iodure de potassium + nitrate de plomb (II) nitrate de
potassium + iodure de plomb (II)
b. Le zinc réagit avec le chlorure d’étain (II) afin de former le
chlorure de zinc et l’étain.
c. Le sulfure de sodium réagit facilement avec le gaz de chlore
pour former le chlorure de sodium et soufre
d. L’oxyde de cuivre (II) se décompose et forme le cuivre et
l’oxygène
 6
6
1
/
6
100%