Composés moléculaire: partager

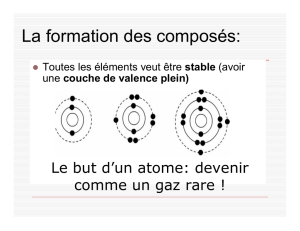
Toutes les éléments veut être stable-
avoir une couche de valence plein.
Les atomes peuvent gagner, perdre ou
partager des électrons avec d’autres atomes
pour remplir leur couche de valence et obtenir
une configuration stable- comme les gaz
nobles!
La formation des composés:
Le but d’un atome: devenir
comme un gaz noble !

Composés moléculaire: partager
Deux non-métaux qui partagent un ou
des électron(s) pour avoir une couche de
valence complet:
liaison simple (partagent une paire d’électrons)
liaison double (2 paires d’électrons)
liaison triple (3 paires d’électrons)
Les atomes restent neutre (pas de charge!)

Composés moléculaire
Les atomes qui partagent des paires
d’électrons son unis par une liaison
covalente.
Un molécule est un particule neutre
composés d’atomes reliés par des
liaisons covalentes.

Composés moléculaires
C
CO2
O
O

Composés moléculaires
Cl
Cl2
Cl
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%