Binary Ionic Compounds Formula Writing

Nommé et écrire la formule des
composés binaires ioniques

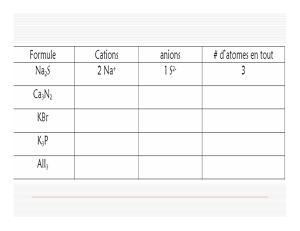
Composés ioniques binaires
Un composé ionique est un cation
(métaux) et un anion (non-métaux).
Un composé binaire est composé de
seulement deux éléments différents.
Ex: NaCl, MgCl2.
NaOH n’est pas binaire.

Écrire la formule d’un composé
ionique binaire
Quand on écrit la formule il faut que
les charges des cations et des anions
soit balancées.
Une façon de s’assurer que les
charges sont balancées est d’utiliser
le “chassé-croisé”.

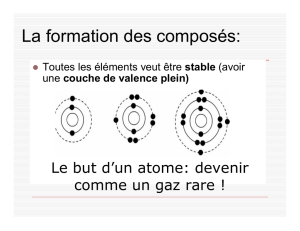
Méthode “chasé-croisé”:
Au lieux d’utiliser des diagrammes de
Lewis pour trouver la formule des
composés ionique, on peut utiliser la
méthode “chassé-croisé”
Méthode “chasé-croisé”:
Détermine la charge du cation
Détermine la charge de l’anion
Croisé les charges (ignore +/-)
Réduit le ratio si nécessaire

Méthode “chassé croisé”
Na Cl
NaCl
1+-1
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
1
/
17
100%