Jeudi 13 Février 2014 - Chirurgie

Jeudi 13 Février 2014
Lithiase biliaire
RESUMES
Lithiase vésiculaire / Cholécystectomie prophylactique
- Lithiase vésiculaire
• Micro lithiase, Origine Ethnique : N. Golse (Lyon)………………………...............2
• Lithiase vésiculaire et obésité : M. Robert (Lyon)…………………………………..5
• Lithiase vésiculaire et nutrition artificielle : B. Darnis (Lyon)…………………… 8
• Lithiase vésiculaire et médicaments : K. Mohkam (Lyon)………………………….10
• Lithiase vésiculaire et grossesse : M. Poiblanc (Lyon)……………………………..15
- Cholécystectomie prophylactique
• Polypes vésiculaires : J. Perinel (Lyon)…………………………………….……….19
• Anomalie de jonction bilio-pancréatique : R. Kianmanesh (Reims)……….……….23
• Pancréatite aiguë d’étiologie indéterminée : O. Risse (Grenoble)………………….29
Cholécystite aigüe / Cholécystectomie
- Cholécystectomie
• Cholécystectomie par trocart unique : G. Poncet (Lyon)…………………………31
• Cholécystectomie en ambulatoire : N. Berthoux, MO. Robert (Arnas)…………..33
- Cholécystite aigüe
• Cholécystite aiguë lithiasique : quand opérer ? D. Fuks (Paris)……………………39
• Cholécystite aiguë lithiasique : quelle antibiothérapie ? JM. Régimbeau (Amiens) .42
• Cholécystite alithiasique : E. Buc (Clermont-Ferrand)……………………………..43
• Cholécystostomie : indications et aspect technique : A. Rode (Lyon)……………..44
Plaie des VB / Lithiase VBP
- Plaie des voies biliaires
• Prévention : L. Chiche (Bordeaux)…………………………………………………47
• Gestion péri opératoire : C. Létoublon (Grenoble)…………………………………49
• Aspects médico-légaux : C. Gouillat (Lyon) ……………………………...………..52
- Lithiase VBP
• Endoscopie : T. Ponchon (Lyon) …………………………………………………..
• Radiologie : A. Rode (Lyon)………………………………………………………..53
• Chirurgie (trucs et astuces): F. Borie (Nîmes) …………………………………….55
Lithiase VBP /Lithiase intrahépatique
- Lithiase VBP
• Angiocholite aiguë grave : stratégie thérapeutique P. Pessaux (Strasbourg)……….59
- Lithiase intrahépatique
• Lithiase intrahépatique: mise au point O. Farges (Paris)………………………….61
• Lithiase et anastomose bilio-digestive : S. Truant (Lille) …………………………63

Nicolas GOLSE, Hôpital de la Croix Rousse, Lyon
MICROLITHIASE, ORIGINE ETHNIQUE
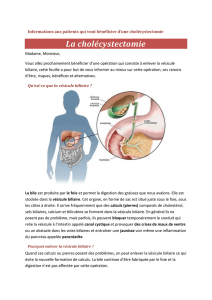
La cholécystectomie est l’une des interventions les plus pratiquées en France, notamment depuis
l’avènement de la cœlioscopie. Il s’agit en effet d’un geste souvent simple et qui permet de prévenir
efficacement 1/ les complications potentielles d’un enclavement ou d’une migration lithiasique et 2/ le
cholangiocarcinome vésiculaire. Pourtant, la probabilité qu’une lithiase asymptomatique devienne
symptomatique est faible (2%/an) et le premier symptôme est habituellement une crise de colique
hépatique, laissant alors le temps au patient de consulter. Concernant le risque de cancer, celui est très
faible dans les pays occidentaux, de l’ordre de 0.02%/an, ne justifiant donc pas à lui seul un geste
prophylactique. Ainsi, accroître le nombre de cholécystectomies aboutirait à une augmentation de la
morbi-mortalité secondaire, et notamment du risque de plaies des voies biliaires1, sans nécessairement
apporter de bénéfice aux patients.
Si la conférence de consensus de 1991 et les recommandations de la Société Nationale Française de
Gastro-Entérologie (2010) précisaient déjà les indications de cholécystectomie, les nouvelles
recommandations de la Haute Autorité de Santé rappellent les rares situations où une lithiase
vésiculaire asymptomatique doit être prise en charge. Il existe pourtant d’autres cas où une
cholécystectomie prophylactique pourrait être discutée : il s’agit de la microlithiase, ou de la lithiase
chez certaines populations à haut risque. Nous verrons donc dans cette mise au point les arguments qui
pourraient inciter à élargir les indications opératoires.
1. Calculs de petite taille
La microlithiase vraie
Sont définis comme microlithiase des calculs formés de cristaux de cholestérol ou de bilirubinate de
calcium, localisés dans la vésicule ou la voie biliaire principale. Par définition, ces calculs ont un
diamètre inférieur à 3 mm et ne sont donc pas visibles en échographie transpariétale. Leur
visualisation est possible à l’écho-endoscopie2 mais le gold-standard demeure l’examen
microscopique de la bile et l’analyse en lumière polarisée. La microlithiase doit donc être différenciée
du sludge qui, lui, est visible à l’échographie transpariétale, et correspond à des cristaux assemblés sur
une matrice muqueuse. Etant donnée la lourdeur diagnostique de la microlithiase, on comprend donc
qu’aucune microlithiase ne puisse être diagnostiquée de façon fortuite… Les circonstances classiques
aboutissant à ce diagnostic sont la suspicion de dysfonction du sphincter d’Oddi, les pancréatites
aigües idiopathiques et les douleurs post-cholécystectomies3. Le traitement classique de la
microlithiase repose habituellement sur la cholécystectomie, même si la sphinctérotomie et la
dissolution médicamenteuse (acide ursodésoxycholique) sont des alternatives possibles4-6.
Nous comprenons donc pourquoi la microlithiase n’est finalement pas une problématique entrant dans
le cadre de la lithiase asymptomatique, à l’inverse des calculs légèrement plus gros et qui, eux,
peuvent être diagnostiqués fortuitement.
La « mini » lithiase
Dans le cadre de la mise au point par la HAS, l’un des aspects de chirurgie prophylactique qui n’a pas
été abordé est celui des calculs de petites dimensions, de l’ordre de 3 à 5 mm, découvert au cours d’un
examen systématique ou dans le cadre d’un bilan pour une autre pathologie. La problématique de ces
calculs est leur propension à migrer plus facilement à travers le canal cystique. Il y a déjà 30 ans,
Houssin et al.7 proposait une cholécystectomie prophylactique, en l’absence de comorbidité notable,
notamment pour réduire le risque de pancréatite. Plus récemment, Venneman et al.8 ont analysé la
symptomatologie biliaire en fonction du diamètre du plus gros ou du plus petits calcul. Les patients
ayant eu une pancréatite ou un ictère obstructif avaient des calculs plus petits que ceux n’ayant pas eu
de complication ou ayant présenté une cholécystite. Ils rapportent également un diamètre moyen
inférieur dans le groupe de patients ayant eu une pancréatite, comparé à ceux ayant développé un
ictère obstructif (4 ± 1 vs 8 ±1, p<0,01). L’analyse multivariée retrouvait la présence de calcul ≤ 5 mm
comme facteur de risque indépendant de pancréatite. L’intérêt d’une chirurgie prophylactique (gain

d’années de survie) était en revanche plus difficile à prouver puisque très dépendant de l’incidence
retenue de la pancréatite et de l’estimation de sa mortalité.
Ces séries sont très certainement insuffisantes pour élargir les recommandations vers de plus larges
indications de chirurgie prophylactique en présence de petite lithiase. Elles permettent cependant au
chirurgien d’être probablement plus vigilant chez ce type de patients et, peut-être, d’être plus enclin à
une cholécystectomie en cas de symptômes, mêmes atypiques, ou de chirurgie abdominale pour
pathologie non biliaire.
2. Génétique de la lithiase biliaire
La maladie biliaire a une composante génétique indéniable. De simples études observationnelles
suffisent à s’en convaincre, avec notamment une incidence élevée de lithiase au sein des parents au
premier degré du cas index9. Des études de cohorte plus larges ont permis d’estimer à 25-30%
l’imputabilité de l’héritage génétique dans la survenue de lithiase10,11. Plusieurs dizaines de gènes
ont finalement été proposés comme déterminants dans l’apparition de calculs. La majorité de ces
gènes interviennent dans le métabolisme des acides biliaires (principalement diminution de leur
sécrétion) ou du cholestérol, modifiant l’équilibre fragile (triangle de Small) du mécanisme de
solubilisation du cholestérol (théorie micellaire).
L’une des anomalies les plus connues demeure le syndrome MDR3 (Multi drug resistance 3, ou Low
phospholipid-associated cholelithiasis) causé par une mutation sur le gène ABCB4. Cette anomalie
entraine une réduction de l’excrétion biliaire de phosphatidylcholine. responsable de la formation de
micelles détergentes à haut pouvoir lithogène. Plusieurs critères sont nécessaires pour le diagnostic
(symptômes biliaires avant 40 ans, récidive des symptômes après cholécystectomie, cholestase
modérée…) et le traitement repose sur l’acide ursodésoxycholique.
L’influence du bagage génétique est également mise en évidence par les variations d’incidence selon
l’origine géographique des populations. Plusieurs populations sont particulièrement à risque,
notamment chez certaines ethnies d’Amérique du sud (Mapuche) ou en Inde12. L’impact de nombreux
facteurs environnementaux doit également être pris en compte, même si cela ne permettrait pas
d’expliquer que les populations émigrées gardent une prévalence de lithiase proche de celle de leur
groupe d’origine et non pas de celui des populations d’accueil13,14.
Au Chili, le cancer vésiculaire est la première localisation de cancer, avec une lithiase retrouvée dans
85% des cas et un risque de cancer multiplié par 7 en présence d’une lithiase. La moitié des patients
porteurs de lithiase seront symptomatiques. La même problématique est posée dans la région de Delhi
(Inde).
De nombreux auteurs préconisent donc une cholécystectomie prophylactique dans ces populations à
haut risque de cholangiocarcinome vésiculaire, notamment indiennes15 et chiliennes16, même si le
niveau de preuve demeure assez faible. Cette attitude pouvait aussi être retenue d’après les
recommandations de l’Organisation Mondiale de Gastro-entérologie de 2007.
En conclusion, la littérature ne permet actuellement pas d’élargir les indications de cholécystectomie
prophylactique aux patients porteurs de petite lithiase. Le bénéfice individuel devra être pesé pour
chaque cas, mais la cholécystectomie pourra être proposée au moindre symptôme ou d’antécédents
biliaires au premier degré. Pour les rares ethnies à haut risque de lithiase et de cholangiocarcinome
vésiculaire, les recommandations de l’Organisation Mondiale de Gastro-entérologie de 2007 autorisent
à un geste de cholécystectomie prophylactique. A défaut, une surveillance renforcée (dont les
modalités ne sont pas définies) sera nécessaire.
1. Lubikowski J, Chmurowicz T, Post M, Jarosz K, Białek A, Milkiewicz P, et al. Liver
transplantation as an ultimate step in the management of iatrogenic bile duct injury complicated by
secondary biliary cirrhosis. Ann Transplant. 2012 Apr;17(2):38–44.
2. Ardengh JC, Malheiros CA, Rahal F, Pereira V, Ganc AJ. Microlithiasis of the gallbladder:
role of endoscopic ultrasonography in patients with idiopathic acute pancreatitis. Rev Assoc Med
Bras. 2010 Jan;56(1):27–31.
3. Abeysuriya V, Deen KI, Navarathne NMM. Biliary microlithiasis, sludge, crystals,
microcrystallization, and usefulness of assessment of nucleation time. HBPD INT. 2010 Jun;9(3):248–
53.

4. Evans WB, Draganov P. Is empiric cholecystectomy a reasonable treatment option for
idiopathic acute pancreatitis? Nat Clin Pract Gastroenterol Hepatol. 2006 Jul;3(7):356–7.
5. Saraswat VA, Sharma BC, Agarwal DK, Kumar R, Negi TS, Tandon RK. Biliary
microlithiasis in patients with idiopathic acute pancreatitis and unexplained biliary pain: response to
therapy. J Gastroenterol Hepatol. 2004 Oct;19(10):1206–11.
6. Gerke H, Baillie J. Biliary microlithiasis: a neglected cause of recurrent pancreatitis and
biliary colic? J Gastroenterol Hepatol. 2005 Apr;20(4):499–501.
7. Houssin D, Castaing D, Lemoine J, Bismuth H. Microlithiasis of the gallbladder. Surg
Gynecol Obstet. 1983 Jul;157(1):20–4.
8. Venneman NG, Buskens E, Besselink MGH, Stads S, Go PMNYH, Bosscha K, et al. Small
gallstones are associated with increased risk of acute pancreatitis: potential benefits of prophylactic
cholecystectomy? Am J Gastroenterology. 2005 Nov;100(11):2540–50.
9. Attili A-F, De Santis A, Attili F, Roda E, Festi D, Carulli N. Prevalence of gallstone disease in
first-degree relatives of patients with cholelithiasis. World J Gastroenterol. 2005 Nov 7;11(41):6508–
11.
10. Katsika D, Grjibovski A, Einarsson C, Lammert F, Lichtenstein P, Marschall H-U. Genetic
and environmental influences on symptomatic gallstone disease: a Swedish study of 43,141 twin pairs.
Hepatology. 2005 May;41(5):1138–43.
11. Nakeeb A, Comuzzie AG, Martin L, Sonnenberg GE, Swartz-Basile D, Kissebah AH, et al.
Gallstones: genetics versus environment. Ann Surg. 2002 Jun;235(6):842–9.
12. Stinton LM, Shaffer EA. Epidemiology of Gallbladder Disease: Cholelithiasis and Cancer.
Gut Liver. 2012;6(2):172.
13. Moro PL, Checkley W, Gilman RH, Cabrera L, Lescano AG, Bonilla JJ, et al. Gallstone
disease in Peruvian coastal natives and highland migrants. Gut. 2000 Apr;46(4):569–73.
14. Kapoor S, Nundy S. Bile Duct Leaks from the Intrahepatic Biliary Tree: A Review of Its
Etiology, Incidence, and Management. HPB Surg. 2012;2012:1–9.
15. Mohandas KM, Patil PS. Cholecystectomy for asymptomatic gallstones can reduce gall
bladder cancer mortality in northern Indian women. Indian J Gastroenterol. 2006 May;25(3):147–51.
16. Randi G, Franceschi S, La Vecchia C. Gallbladder cancer worldwide: geographical
distribution and risk factors. Int J Cancer. 2006 Apr 1;118(7):1591–602.

Maud ROBERT, Hôpital Edouard Herriot, Lyon.
LITHIASE VESICULAIRE ET OBESITE : PLACE DE LA CHOLECYSTECTOMIE
PROPHYLACTIQUE ?
1. Etat des lieux
L’obésité est une véritable pandémie : la dernière enquête ObEpi 2012 recensait 6.9 Millions d’obèses
en France soit 15% de la population et une augmentation de 76% depuis 1997. L’obésité est reconnue
comme une véritable maladie chronique, entraînant de nombreuses pathologies graves ou co-
morbidités que sont principalement le diabète de type II, l’hypertension artérielle, le syndrome
d’apnée du sommeil, la dyslipidémie et les pathologies ostéo-articulaires, et constitue ainsi un enjeu
prioritaire de santé publique. Plusieurs études ont démontré que la prise en charge chirurgicale de
l’obésité était supérieure au traitement médical en termes de perte de poids, d’amélioration des co-
morbidités et de la qualité de vie(1). Face à ce constat, le nombre des procédures bariatriques a
augmenté de façon exponentielle depuis le début des années 2000, en parallèle avec l’avènement de la
laparoscopie. Entre 2005 et 2011, le nombre de procédures bariatriques en France a été multiplié par
2,5 et est passé de 12771 à 30 881 procédures annuelles, comprenant 43.9% de Sleeve Gastrectomy
(SG), 30.6% de bypass gastriques (GBP), 24.8% d’anneaux et 0.7% de Diversions Bilio-Pancréatiques
(DBP).
L’incidence de la lithiase vésiculaire dans la population générale est de 13.6%(2). Le nombre de
cholécystectomies en France en 2010 était de 106 060 (données de la Haute Autorité de Santé).
L’Obésité apparaît comme un facteur de risque, augmentant l’incidence de la lithiase de 21 à 38.5%
dans la population obèse(2, 3). Plusieurs études histologiques de la vésicule dans la population obèse
ont retrouvé 86 à 97% d’anomalies retrouvant 25% de calculs, 50% de cholécystites chroniques et
38% de sludge(4).
2. Incidence de la lithiase vésiculaire après chirurgie bariatrique
L’incidence de la lithiase vésiculaire augmente après chirurgie bariatrique, dès le 3ème mois et jusqu’à
2 ans post-opératoires. Pendant les deux 1ères années après la chirurgie, le risque relatif de survenue
d’une lithiase vésiculaire serait de 5.8(2). Plusieurs mécanismes ont été impliqués dans la lithogénèse
et notamment la perte de poids rapide et importante. Une Perte d’Excès de Poids >50% à 3 mois serait
un facteur prédictif indépendant de lithiase symptomatique (5). Les interventions mal absorptives avec
anse commune courte (DBP, bypass distal, Bypass en Oméga) seraient également associées à la
lithogénèse(6). D’autres facteurs ont été impliqués comme l’augmentation de mucine et de calcium
biliaire, la diminution de la cholécystokinine et de la Ghreline jouant un rôle dans le ralentissement de
la vidange vésiculaire, ainsi qu’une augmentation du rapport cholestérol/ (acides biliaires +
Phospholipides). Une incidence de 3 à plus de 28% de lithiase symptomatique après GBP a été
rapportée dans la littérature(7).
3. Options thérapeutiques
La prise en charge de la lithiase vésiculaire asymptomatique est sujet à controverse depuis de
nombreuses années et aucun consensus n’a encore été établit(5,7-10). L’incidence de la lithiase chez
l’obèse et son augmentation après chirurgie bariatrique associée aux risques de complications biliaires
sont à mettre en balance avec les risques propres de la cholécystectomie et sont à l’origine du débat.
De nombreux auteurs sont en faveur de la cholécystectomie prophylactique, principalement pour les
interventions bariatriques à l’origine d’une perte de poids rapide et importante de type bypass
gastrique(7,9). D’autres privilégient le traitement médical préventif à base d’acide ursodésoxycholique
(5, 8).
4. Données bibliographiques
Les données bibliographiques sont nombreuses mais le niveau de preuve reste insuffisant pour clore le
débat. Une seule métaanalyse récente a évalué le taux et la morbidité de la cholécystectomie
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
1
/
64
100%



![Patho = lithiase biliaire[1]](http://s1.studylibfr.com/store/data/003517627_1-43288d8639333e6159d2f8e7ef75ace1-300x300.png)