I) Préparation de l`acétal

TP : Protection d’une fonction cétone et préparation d’une -énone
Préparer les questions 1, 2 ,3 ,4 ,5 ,8, 9.
I) Préparation de l’acétal
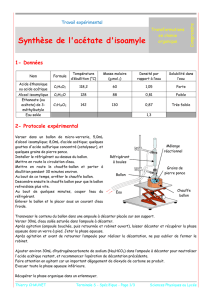
Dans un ballon 100 mL, placer 10 g d’acétoacétate d’éthyle, 5 g
d’éthylèneglycol, une pointe de spatule d’APTS, 30 mL de toluène et qq grains
de pierre ponce.
Installer le montage utilisant un appareil Dean-Stark
dont le schéma est ci-contre :
Vous installerez deux réfrigérants
en série de façon à faire la partie II
pendant le temps de chauffage du I.
Chauffer à reflux jusqu’à ce que vous ayez
distillé le volume d’eau prévu à la question 3).
Questions :
1) L’acétoacétate d’éthyle est en fait le 3-oxobutanoate d’éthyle ; donner la
formule semi-développée de ce composé.
2) Donner l’équation-bilan de la réaction entre l’acétoacétate d’éthyle et
l’éthylèneglycol ( ou éthanediol ).
3) L'équilibre est déplacé par distillation azéotropique de l'eau formée en
présence de toluène ; le toluène et l'eau, non miscibles à l'état liquide, forment
un hétéroazéotrope que l'on récupère dans la colonne graduée de l'appareil de
Dean-Stark ; la réaction est alors totale ; calculer le volume d’eau obtenu à la
fin de la réaction.
4) Expliquer pourquoi l’équilibre est déplacé vers l’acétal quand on élimine l’eau
du mélange réactionnel au fur et à mesure de sa formation.
5) Quel est le rôle de l’APTS ( ou acide paratoluènesulfonique ) ?
Refroidir le ballon à l’air ambiant puis sous l’eau du robinet.
Placer le mélange dans une ampoule à décanter et ajouter 20 mL d’une solution
de soude à 10% ; agiter ; laisser décanter ; extraire la phase organique.
Laver cette phase deux fois avec 20 mL d’eau saturée en sel.
Sécher la phase organique avec du sulfate de magnésium sec ; filtrer.
Evaporer le toluène à l’aide d’un évaporateur rotatif ( peser le ballon à
évaporation avant ).
Peser le produit obtenu.
6) Calculer le rendement de la synthèse.
7) Tracer le spectre IR de votre produit et comparer à celui de l’acétoacétate
d’éthyle ; conclure.
II) Préparation du bromure de phénylmagnésium
Réaliser le montage ci-contre avec de la verrerie placée à l’étuve :
Graisser tous les rôdages et placer en haut du réfrigérant
du coton avec de chlorure de calcium.
Ecraser 1 g de magnésium dans un mortier puis le placer
dans le ballon avec 10 mL d’éther anhydre.
Dans l’ampoule isobare, placer 10 mL d’éther anhydre
et 2,8 g de bromobenzène. Verser un peu de cette solution
dans le ballon en agitant.
Placer un cristal de diode puis chauffer à l’aide d’un sèche-cheveux
jusqu’à ce que le mélange se décolore et que l’éther reflue.
Verser la solution de bromobenzène goutte à goutte, en agitant et
en surveillant le reflux.
Si le reflux devient insuffisant, placer un bain-marie d’eau chaude.
Si au contraire l’ébullition est trop vive, arrêter le goutte à goutte voire refroidir le
mélange.
Quand l’addition est terminée , chauffer à reflux pendant 15 min.
Refroidir le ballon dans de l’eau froide.

III) Action de l’acétal sur l’organomagnésien
Préparer une solution en plaçant 1,5 g d’acétal préparé au I) dans 10 mL d’éther
anhydre et placer cette solution dans l’ampoule à brome du montage du II).
Verser goutte à goutte, en agitant, la solution d’acétal dans le ballon contenant
l’organomagnésien ( attention réaction très exothermique ).
Continuer à agiter à T ambiante pendant 15 min ; si un précipité blanc apparaît,
ajouter de l’éther anhydre.
Placer dans le ballon 10 mL d’eau et 10 g de glace.
Quand la glace est fondue, ajouter 10 mL d’éther ( plus de l’anhydre ) ou plus si
le précipité ne disparaît pas et agiter.
Placer le mélange dans une ampoule à décanter ; extraire la phase organique et
laver la phase aqueuse avec 20 mL d’éther.
Joindre les deux phases organiques et laver avec 20 mL d’eau salée.
Sécher la phase orga avec du sulfate de magnésium sec ; filtrer et évaporer l’éther
à l’évaporateur rotatif.
Peser le produit.
8) Donner le mécanisme de la réaction entre l’acétal et l’organomagnésien.
9) Donner la formule puis le nom de l’alcool formé.
10) Calculer le rendement de cette réaction.
11) Tracer le spectre IR de votre produit et comparer à celui de l’acétal; conclure.
IV) Purification de l’alcool
Recristalliser le produit préparé au III) dans un minimum d’éther de pétrole et en
utilisant un réfrigérant à air.
Si des cristaux précipitent, filtrer la solution. Si les cristaux n’apparaissent pas
même en grattant les parois de l’erlen, évaporer le solvant à l’évaporateur rotatif
et passer au V).
V) Synthèse d’une
-énone par procédé minichimie
Placer 0,5 g de l’alcool purifié dans un réacteur 10 mL, ainsi que 5 gouttes
d’acide chlorhydrique concentré, 0,2 mL d’eau distillée et 5 mL d’acétone.
Installer le petit réfrigérant sur le réacteur 10 mL.
Chauffer à reflux à l’aide d’un bain de sable placé sur une plaque chauffante,
pendant 20 min.
Laisser refroidir à T ambiante puis verser le mélange dans 5 mL d’eau ; rincer
le réacteur avec un peu d’eau et rajouter cette eau de rinçage à la solution.
Placer la solution dans la petite ampoule à décanter et extraire deux fois avec
10 mL d’éther.
Rassembler les phases orga et laver avec 10 mL d’une solution saturée
d’hydrogénocarbonate de sodium puis avec 10 mL d’eau distillée.
Sécher la phase orga avec du sulfate de magnésium sec ; filtrer et évaporer le
solvant à l’évaporateur rotatif.
Peser le produit.
12) Si on obtient une
-énone, quelles réactions ont eu lieu pendant cette étape ?
13) Donner la formule semi-développée de cette
-énone.
14) Calculer le rendement de cette étape.
15) Tracer le spectre IR de votre produit et comparer à celui de l’alcool;
conclure.
VI) Etude de la pureté de l’
-énone par CCM
Préparer la cuve CCM en plaçant un peu de toluène et fermer la cuve pendant
15 min.
Dissoudre un peu d’alcool synthétisé au III) dans 2 mL de toluène contenu dans
un tube à essai.
Faire de même pour l’-énone.
Faire un dépôt de chaque solution sur une plaque de silice et la placer dans
la cuve.
Révéler aux UV ; conclure sur la pureté de l’-énone synthétisée au V).

TP11 : Protection d’une fonction cétone et préparation d’une -énone
Matériel :
Par paillasse :
Ballon 100 mL, clips
Appareil Dean-stark +réfrigérant
Support élévateur
Autre réfrigérant en série ( attention longueur tuyaux )
Ampoule à décanter 125 mL + support + bouchon
2 béchers 125 mL
spatule
entonnoir verre
papier filtre
ballon ou erlen à évaporation
erlen + bouchon + tube effilé
agitateur en verre
büchner
fiole à vide
trompe à vide
pour organomagnésien : ( étuve )
ballon 250 mL + bouchons verre
ampoule à brome + bouchon verre
magnésium
plaque chauffante-agitante + barreau
sèche-cheveux
cristaux iode
mortier + pilon
cristallisoir inox
minichimie :
réacteur 10 mL + réfrigérant
bain de sable
plaque chauffante avec pince
petite ampoule à décanter
commun :
évaporateur rotatif
Pierre ponce
Graisse
Solutions, produits :
Acétoacetate d’éthyle ( 10g :gr )
Ethylèneglycol ( 5g/gr )
APTS
soude 10% en masse ( 20 mL/gr )
toluène ( 30 mL/gr )
eau saturée en sel ( 60 mL/gr )
MgSO4 sec
Ether anhydre ( 40 mL/gr )
Ether ( 50 mL/gr )
Ether de pétrole ( 10mL/gr )
Bromobenzène ( 3g/gr )
acide chlorhydrique concentré ( 5 gouttes /gr )
acétone (5 mL/gr)
solution saturée d’hydrogénocarbonate de sodium (10 mL/gr)
1
/
3
100%