Synthèse d'un ester : TP corrigé de chimie organique

XXV° Olympiades de la chimie – Lycées Périer-Thiers
Thème : Les bioressources
TP n°1 : Synthèse d’un ester à l’odeur de banane
Fiche réponse – CORRIGE
Partie 1 :
Questions expérimentales :
1.
Donner la signification des phrases de risque et de sécurité R/S pour chaque réactif
utilisé.
Acide éthanoïque :
R10 : Inflammable
R35 : Provoque de graves brûlures.
S1 :Conserver sous clé.
S2 : Conserver hors de la portée des enfants.
S23 : Ne pas respirer les vapeurs.
S26 : En cas de contact avec les yeux, laver immédiatement et abondamment avec de l’eau et
consulter un spécialiste.
S45 : En cas de malaise consulter un médecin ( si possible lui montrer l’étiquette ).
3-méthylbutan-1-ol :
R10 : Inflammable.
R20 : Nocif par inhalation.
S24/25 : Eviter le contact avec la peau et les yeux.
Ethanoate de 3-methylbutyle :
R11 : Facilement inflammable.
R66 : Une exposition répétée pourrait assécher la peau ou la crevasser.
S16 : Conserver à l’écart de toute flamme ou source d’étincelles- Ne pas fumer.
S23 :Ne pas respirer les gaz /vapeurs/fumées/aérosols.
S25 : Eviter le contact avec les yeux.
S29 : Ne pas jeter les résidus à l'égout.
APTS :
R36/37/38 : Irritant pour les yeux, les voies respiratoires et la peau.
S2 : Conserver hors de la portée des enfants.
S26 : En cas de contact avec les yeux, laver immédiatement et abondamment avec de l’eau et
consulter un spécialiste.
S37 : Porter des gants appropriés
Toluène :
R11 : Facilement inflammable.
R38 : Irritant pour la peau.
R48/20 : Nocif : risque d’effet graves pour la santé en cas d’exposition prolongée par
inhalation.
R63 : Risque possible pendant la grossesse d’effets néfastes pour l’enfant.
R65 : Nocif : peut provoquer une atteinte des poumons en cas d'ingestion.
R67 : L'inhalation de vapeurs peut provoquer somnolence et vertiges.
S2 : Conserver hors de la portée des enfants.
S36/37 : Porter un vêtement de protection et des gants appropriés.
S46 : En cas d’ingestion consulter immédiatement un médecin et lui montrer l’emballage ou
l’étiquette.

S62 : En cas d’ingestion, ne pas faire vomir : consulter immédiatement un médecin et lui
montrer l’emballage ou l’étiquette.
2.
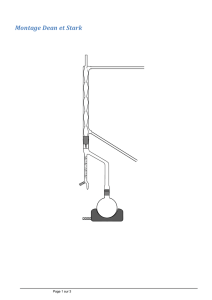
Légender le montage de la synthèse directement sur l’énoncé.
3.
Pourquoi chauffe t-on ?
On chauffe pour augmenter la vitesse de la réaction ( T est un facteur cinétique ).
4.
Quel est le rôle du réfrigérant ? Justifier le nom de montage à reflux.
Le réfrigérant sert à condenser les vapeurs. On travaille ainsi à volume constant. Les vapeurs
montent dans le réfrigérant ( flux ) et redescendent sous forment liquide ( reflux ).
5.
Quel est le rôle du Toluène ?
Le toluène entraîne l’eau produite lors de la réaction d’estérification.
6.
Quel est le rôle de la pierre ponce ?
La pierre ponce sert à réguler l’ébullition.
7.
Quel est le rôle de l’APTS ?
L’APTS ( Acide ParaToluène Sulfonique ) est un acide, il catalyse la réaction ( augmente la vitesse
de la réaction ).
8.
Dans le décanteur, où se situe la phase aqueuse et le toluène ? Justifier.
d(Toluène) = 0,87 < 1 donc le Toluène se situe dans la phase inférieure
Questions théoriques :
1.
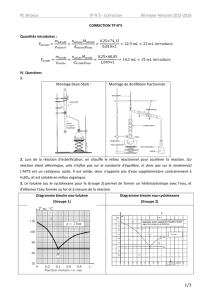
Calculer les quantités de matières initiales des réactifs.
n(acide) = m/M = µ×V/M = 1,05×30/60 = 0,53 mol
n(alcool) = m/M = µ×V/M = 0,81×24/88 = 0,22 mol
2.
Faire un tableau d’avancement et déterminer le réactif limitant.
CH3
CH3
OH OH CH3
O
CH3
CH3
O CH3
O
++OH2
APTS
E.I
0,22
0,53
0
0
E.Int
0,22
-
x
0,53
-
x
x
x
E.F
0,22
-
x
f
0,53
-
x
f
x
f
x
f
Sortie d’eau
Entrée d’eau
Dean Stark
Bécher
Ballon
Chauffe ballon
Réfrigérant
Milieu réactionnel

L’alcool est le réactif limitant et xmax = 0,22 mol
3.
Dans quel but introduit-on un réactif en excès ?
La concentration des réactifs est un facteur cinétique. En introduisant un réactif en excès
( souvent le moins cher ) on augmente la vitesse de la réaction.
4.
Calculer la masse théorique d’ester que l’on pourrait espérer obtenir si la réaction
d’estérification était totale.
mth = n × Mester = xmax × Mester = 0,22 × 130 = 29 g
Partie 2 :
1.
Faire un schéma de l’ampoule à décanter en indiquant la composition des 2 phases.
Phase organique
Phase aqueuse
Dans la phase organique : Ester, Toluène + traces d’eau et d’acide
Dans la phase aqueuse : Eau salée, Acide + traces de Toluène et d’ester
2.
Pourquoi ajoute t-on de l’eau salée glacée et pas tout simplement de l’eau ? Quel
nom porte cette technique ?
Cette technique s’appelle le relargage.
En utilisant de l’eau salée, on diminue la solubilité des espèces chimiques organiques restées
solubilisées dans l’eau ( traces de toluène et d’ester ).
Le fait que l’eau soit glacée diminue aussi la solubilité de ces mêmes espèces chimiques ( si T
diminue s diminue ).
3.
Pourquoi doit-on agiter l’ampoule à décanter ?
En agitant l’ampoule à décanter, on augmente la vitesse de transfert des espèces chimiques s’une
phase à l’autre ( on augmente la cinétique de l’extraction ).
4.
Pourquoi faut-il dégazer de temps en temps ?
Le toluène s’évapore dans l’ampoule à décanter ( il faut dégazer de temps en temps pour éviter
une trop forte surpression ).
5.
Quel est le rôle du lavage avec la solution d’hydrogénocarbonate de sodium ? Ecrire
l’équation de la réaction qui a lieu dans l’ampoule à décanter. On donne le couple :
CO
2
,H
2
O/HCO
3
-
.
HCO3- est une base qui va transformer CH3COOH en sa base conjuguée CH3COO- qui n’est plus du
tout soluble dans la phase organique.
Equation bilan de la réaction :
CH3COOH + HCO3- = CH3COO- + CO2,H2O
6.
Quel est le rôle du sulfate de magnésium anhydre ?

Le sulfate de magnésium anhydre est un desséchant chimique qui permet d’enlever les traces
d’eau présentes dans la phase organique.
Partie 3 :
Questions expérimentales :
1.
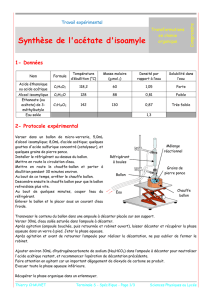
Légender le schéma sur le sujet.
2.
Indiquer les différents paliers de température associé avec l’espèce chimique
distillée.
1èr palier : Téb = 88-89°C : divers produits organiques
2ème palier : Téb = 111°C : distillation du Toluène
3ème palier : Téb = 118°C : Traces d’acide
2ème palier : Téb >120 °C : distillation de l’ester ⇒ On arrête la distillation pour garder l’ester
dans le ballon.
3.
Dans quel but réalise t-on cette manipulation ?
On réalise cette étape principalement afin de séparer le Toluène de l’ester et d’éliminer les
éventuelles impuretés.
4.
Calculer le rendement de la synthèse. Commenter le résultat obtenu.
mexp = 18,7 g
η = mexp/mth × 100 = 18,7/29 × 100 = 65%
Causes possible de la perte en rendement :
Il aurait fallu chauffer plus longtemps (la réaction n’a peut être pas eu le temps de se terminer ).
Il aurait fallu faire plus d’extractions.
Pertes lors de la manipulation.
etc…
Réfrigérant
Eprouvette graduée
Distillat
Entrée d’eau
Sortie d’eau
Thermomètre
Colonne de vigreux
Ballon
Chauffe Ballon
Milieu réactionnel
1
/
4
100%